
非洲猪瘟是由非洲猪瘟病毒引起的急性、接触性传染病。近几年随着非洲猪瘟病毒本身的不断变化,临床症状也变得较为复杂,使得猪场在非洲猪瘟诊断方面存在很多不确定性,为了更好的了解非洲猪瘟田间复杂性,笔者将相关内容汇总如下:
非瘟的最新流行情况
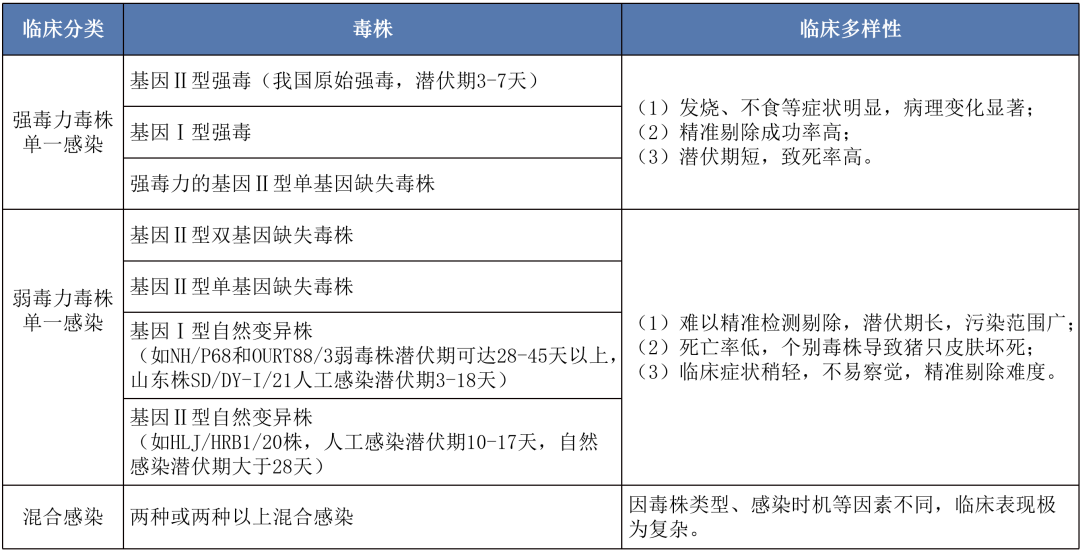
01 田间毒株的多样性
非洲猪瘟病毒目前发现的基因型至少有24种,在我国,非洲猪瘟于2018年8月3日传入,毒株是以高毒力的Georgia-07型非洲猪瘟Ⅱ型病毒为主。2019年出现单基因缺失、双基因缺失弱毒株。但在2020年,我国部分省区出现了低致死率的非洲猪瘟基因Ⅱ型自然变异流行株[1],该毒株主要引起猪只的慢性感染,具有很强的水平传播能力。2021年,在河南省和山东省的猪场中分离到基因Ⅰ型非洲猪瘟病毒低毒力毒株,通过全基因组序列分析表明和葡萄牙分离的基因Ⅰ型高度同源[2],2023年,在我国猪群中检测到基因Ⅰ型和基因Ⅱ型重组株的高致死性非洲猪瘟病毒[3]。由此可见,非洲猪瘟毒株在不断的发生变化,当前我国非洲猪瘟病毒呈现多毒株流行的状态。

02 田间临床特征的多样性
非洲猪瘟病毒不断变异重组,导致了非洲猪瘟毒株临床特征多样性,详见下表:
03 传播途径认知的提升
在传播途径方面,非洲猪瘟主要通过接触传播,并且早期研究资料显示非洲猪瘟病毒通过气溶胶传播的距离较短,主要局限在近距离(2~3米)。但在2023年最新研究通过模型实验证实,ASFV气溶胶的传播距离至少为10米[4]。这给猪场非瘟防控带来了更大的挑战,尤其是对于一点式饲养的猪场。
非瘟的诊断
对于规模化猪场而言,荧光定量PCR检测应用较为广泛,鉴于当前非洲猪瘟田间多样性的变化,猪场在对非洲猪瘟进行临床诊断时,要注意以下几点:
(1)ASFV弱毒感染后,间歇性排毒的特征变得尤为明显,因此对于弱毒感染的猪场,首次采样最好“咽拭子+血液”双来源,同时一个潜伏期内检测两次,并且要保证配对检测。
(2)在非洲猪瘟检测试剂盒选择方面,不要只以阴阳性的临界CT值作为判断试剂盒优良的依据,也要结合“S”曲线的“平台期”稳定性来判定,即试剂盒“有后劲”。
(3)对于非洲猪瘟的临床确诊,猪场最好采用“核酸检测+抗体检测”双保险来综合判定,以排除在非洲猪瘟不同发病时间段对检测结果的影响。
(4)在非洲猪瘟合样检测方面,当猪场在前期排查非瘟过程中发现阳性,且样本病毒含量很高(Ct值20左右)时,在后期紧急全面检测时,可以适当加大合样数量检测(稀释2048倍不影响结果);当前期样本病毒含量较低(Ct值33左右)时,后期不建议大范围合样检测(不超过20个样品)。
当前弱毒居多,猪场一旦检测到猪只的相关样品呈非瘟阳性,往往意味着非瘟病毒已经在猪场内完成了由“点”向“面”的扩散,为时已晚,所以建议猪场应该把防非检测往“猪场外围”拓展,比如猪场周边的道路,车辙、装猪台等,便于早期发现,及时止损。(作者:袁飞)