
随着非洲猪瘟病毒潜伏期的延长和致病力的减弱,对异常猪核酸检测的效率在下降,需要结合抗体检测在引种监测、正常猪群监测预警甚至定点清除等多个环节中提供决策依据。但在抗体检测时频频出现假阳性,这让决策者左右为难。本文根据现场表象、试剂盒原理及抗体动力学规律等就假阳性产生的原因和辨别假阳性的措施进行经验分享,希望有助于兽医科学决策。

一、假阳性常常出现的场景和现象
(1)血液样本在出现溶血、胶冻状或存在败血症时容易出现假阳性,其检测的抗体数值大多为可疑或刚突破阴阳性判定阈值。
(2)抗凝血样本分离血浆后用于检测抗体可能易出现假阳性(注:临床中存在采用抗凝血进行抗原和抗体双检测的实践。即采集的抗凝血离心,血细胞用于核酸检测,其检测核酸的敏感性确实会升高;将抗凝血分离的血浆进行抗体检测,虽然这可避免二次采集全血的麻烦,但这种血浆在检测抗体时容易出现假阳性)。
(3)检测用的洗涤用非去离子水,检测时出现假阳性。
(4)有些样本的检测数值往往是刚刚超出阴阳性判定线,但间隔几天后重复采样复测后抗体检测的数值不再上升或判定结果又为阴性。
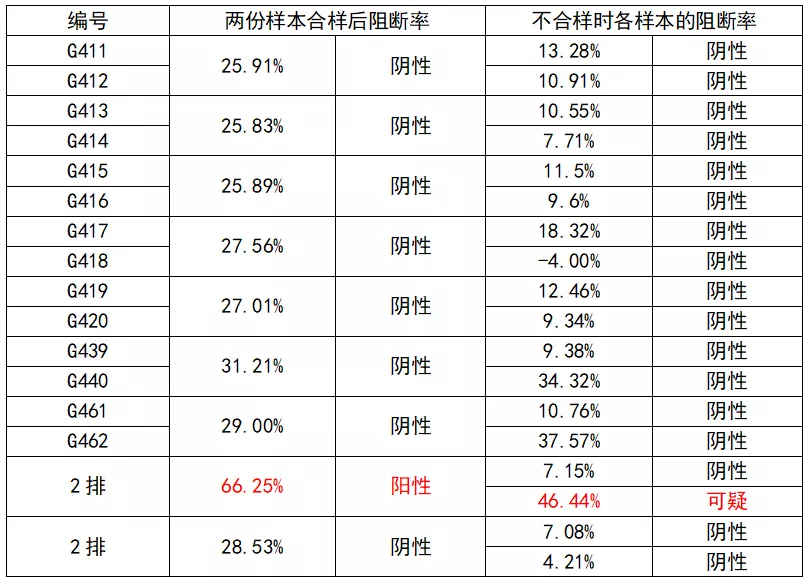
(5)将两份以上的血清样本合样后进行检测,合样后其检测数值升高,合样后的样品结果为阳性,但分别检测单个样本,每个样品抗体判定又是阴性。
表1 两份样本合样后的样本和分别检测每个样本时抗体数值
二、假阳性出现的原因解析
假阳性可能有以下三方面原因
(1)核酸检测方法多针对的是个体定性,而抗体检测方法多针对的是群体检测的数据分析。在特异性这个指标上,核酸检测试剂往往比抗体检测试剂的标准更高。
(2)在非洲猪瘟抗体检测中阻断法或竞争法比间接法更易出现假阳性(注:从其他检测试剂的数据反馈和原理上,间接法应该比竞争法更易出现非特异性反应。但在试剂检测工作中,非洲猪瘟抗体检测中竞争法的假阳性比例更高。但我们不能以这个指标就去简单用于判定试剂盒的优劣,其假阳性发生率应该与试剂盒阴阳性阈值的标准、样本中的干扰因素有关,这需要对检测数据进行统计分析,得到实验室经验的预警值,下文中将会作展示和阐述)。原因可能是阻断法往往是针对单个抗原表位,该表位一旦被封闭,阻碍了该表位与最终显色的酶标一抗的结合,由于阻断法或竞争法是酶标一抗结合越少,判断其抗体效价越高(见图1原理解析),因此容易产生假阳性。表位被非特异性结合可能出现在以下原因中:
图1 竞争ELISA(或通过计算公式为阻断法)抗体检测原理图
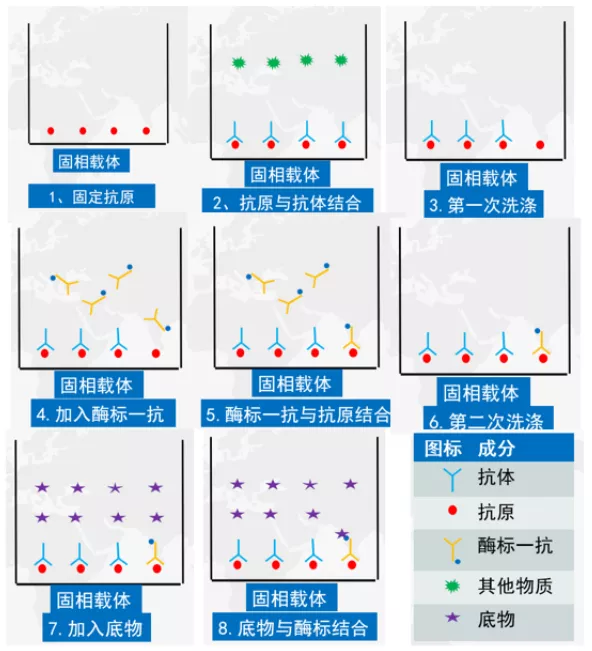
①血清学检测配液和洗涤必须用超纯水。较差的水质带有杂质或者某些离子会导致螯合反应,继而有可能影响二抗的结合。
②抗凝管中肝素抗凝,分离的血浆会增加OD值,可能与高浓度肝素具有强大的负电荷,能吸附酶标记物不易洗脱有关。
溶血、血样呈胶冻状,可能产生螯合反应(也可能就是一种非特异性结合)封闭其抗原表位,进而影响了二抗的结合。
③样本合样后导致的假阳性可能是一种凝集反应。打一个不恰当的比喻,我们都知道不同血清型的人输血有可能出现严重的凝集反应,单个血清中其pH值,和蛋白之间的结合是一个稳态;但当合样后,两种或多种血清之间会发生蛋白间的相互作用或化学反应,形成螯合物有可能覆盖了表位,导致部分二抗无法结合,接近临界值就成为假阳性。
(3)试剂盒的检测敏感性与假阳性的矛盾可能是很难调和的。我们都知道国外是将非洲猪瘟抗体检测试剂用于区域净化的,这就要求更高的敏感性,为了提高敏感性将判定阈值线(cutoff)降低就可能是其中的选项之一。与之类似的是伪狂犬病gE抗体检测试剂,当把阴阳性阈值线调低了之后,会增加假阳性的几率,这也是下文的解决方案中需要做数据分析的原因。
三、不同场景下试剂盒的选择
实验室根据不同场景和不同目的,准备不同的抗体检测试剂盒进行检测和监测。
(1)引种监测(场内还存在生产群)时,因隔离时间短,需要更为敏感的试剂盒,才能在刚感染时及时发现,避免路途中感染的风险。
(2)阴性场或大环境压力较小的规模场,需要用敏感性中等的试剂盒作定期监测,避免因误诊,增加一线人员的工作强度。
(3)发生问题的猪场,在部分清群后,需要用更敏感的检测试剂盒进行监测。
四、如何鉴别假阳性或假阴性
一个假阳性的出现可能会导致猪场进入战时状态,进而打乱猪场的生产节律,会给阴性场造成不必要的巨大损失,因此实验室和兽医团队在上报异常样本时,需同时开始复检。可通过以下措施降低假阳性或避免假阴性。
(1)实验室需要对样本的状态进行登记,对溶血和胶冻状的样本进行特别备注,一旦这些样本检出阳性,就需要怀疑是否是样本状态出现了问题。
(2)外界环境压力比较大时,尽量不要进行样本混合。
(3)复检:针对少量样本的检测结果为刚过阴阳性判定线,但所有呈阳性的样本的检测数值普遍较低时,这种情况下则极有可能出现了假阳性。其他疫病在疫病暴发初期(如蓝耳)的正常样本的检测数值是符合正态分布的,既有高抗体的(感染时间很长了),也有低抗体(刚刚感染的)。非洲猪瘟的p72蛋白免疫原性非常好,其正态分布会很窄,因此在真实的野毒(主要是指弱毒,强毒可能在抗体产生之前已经出现异常而被发现)感染过程中有可能检测结果都是高抗体值的,较少会发现刚刚转阳的个体。非洲猪瘟感染抗体动力学显示,感染后抗体可能在感染后20天即可以达到峰值,因此在临床上很难在刚刚感染时即监测到低抗体数值的样本。
针对上述可疑或弱阳性的样本,有两种方法可用于复检:
①用另一种试剂盒复检。实验室应该准备两种以上的不同抗体检测试剂,正常比例8:2,如配三种可以是7:2:1。配置的不同试剂盒应采用不同的检测方法。
②重新采样,对可疑猪进行隔离,2~3天后重新采样,如果是真阳性抗体数值可能会升高,如果是假阳性复采检测结果有可能转阴性(若复检还是弱阳性,可以淘汰该猪,并监测周边猪群,如周边猪群转阳,紧急将整栋或整条线的猪淘汰处理)。
(4)要对检测数据进行分析,关注接近于阴阳性判断阈值的数值。
分析数据时不能仅看结果判定的阴阳,还需对数值进行统计分析,找到实验室的预警数值。对比不同检测试剂盒的检测数据,会发现有些样本在刚刚转阳时,使用不同试剂盒的结果判定虽然不同,但是有一定的平行关系。
表2 针对感染场的检测数据分析
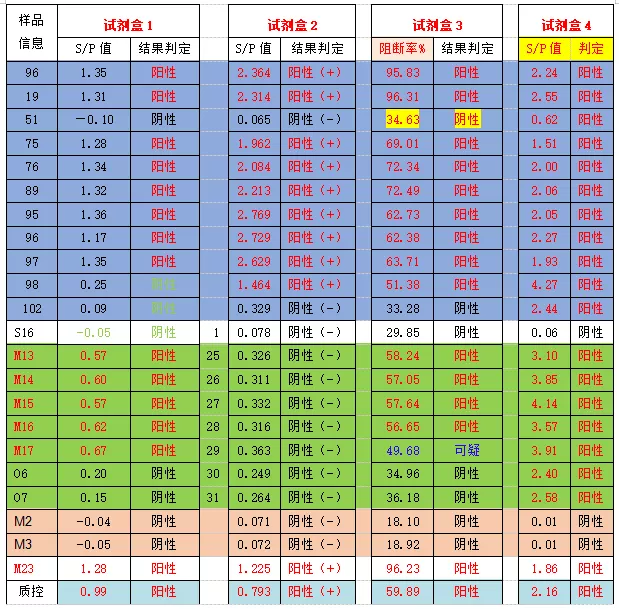
该猪场为持续感染场,蓝色底纹内的数据是首次检测到阳性的样本,其他阳性样本为间隔7天检测到的阳性样本。由上表2数据可见,感染的猪只抗体数值会非常高(蓝色底纹内的数据)。第一种检测试剂盒很敏感,因此M13-M17号(与首次爆点临近的猪只)样本可能刚被感染即检测为弱阳性,对相同样本用第二种检测试剂盒检测,虽判断为阴性,但对表中绿色底纹的数据(试剂盒1判定为阳性,试剂盒2判定为阴性)和橙色底纹内数据(正常判定为阴性的样品数据),真阴性数值<0.1,而M13-M17号样本数值有平行升高。绿色底纹内06和07号样本第四种检测试剂盒检测为阳性,1号检测试剂盒检测为阴性,但第一种、第二种、第三种检测试剂盒的检测抗体水平都有明显升高的现象。
因此实验室不能仅以阈值判断阴阳性,需特别关注检测数据并进行统计分析,找到更能指导临床应用场景的经验阈值或预警数值,避免假阳性和假阴性的判断的失误。
专家点评
随着非洲猪瘟疫情在我国的发展,病毒呈现一定的多样化,弱毒株感染占比在上升。弱毒株潜伏感染能力强,感染临床症状不明显,病毒载量低。通过临床手段很难早发现,单纯地开展荧光PCR检测也不足以早发现和及时清除感染。猪场除了开展荧光PCR检测病原,需要结合抗体监测,减少病原漏检。
检测结果的准确率对兽医决策至关重要。多方面因素会导致抗体检测出现的假阳性,需要从以下几个方面入手,从采样质量、实验室检测环境、检测人员培训、检测耗材等方面保证检测的标准化规范性;另外需要不断提高实验室的评价能力,包括提高检测人员的数据分析能力、对检测试剂盒的评价等等。

文章对非洲猪瘟抗体检测假阳性问题进行了详细的分析,就不同应用场景选择对应试剂盒提出了建议;描述了可能的假阳性结果以便我们分析。
学习该文章可以帮助实验室与一线兽医协同,综合分析数据与临床表现,不断修正在监测预警和疫病流行规律上的检测指标,从而让试剂盒适用于不同的应用场景,让监测融入生产环节,发挥最大的价值。