
会前研讨会1-猪病诊断1
国际兽医检测诊断大会
2024年6月24日上午,第五届国际兽医检测诊断大会暨亚洲兽医器械及药品展览会在杭州国际博览中心召开,会前研讨会1-猪病诊断1(由广州悦洋生物技术有限公司赞助)开讲,主持人为华中农业大学何启盖博士。

图 何启盖博士正在主持
会议日程
1.会前研讨会 1 – 猪病诊断1(由广州悦洋生物技术有限公司赞助)
主持人: 何启盖
8:30am – 高通量检测视角看蓝耳病检测,王衡, 华南农业大学
9:00am – 流行病学与实验室诊断在猪病防控中的应用,何启盖,华中农业大学
09:30am – 猪繁殖与呼吸综合征的流行现状与检测技术,周智,中国动物疫病预防控制中心(悦洋生物特邀)
10:30am – 中国猪圆环病毒的流行与诊断, 李向东, 扬州大学
11:00am – 基因I/II型重组非洲猪瘟病毒的认知和快速检测方法建立,赵东明, 哈尔滨兽医研究所
11:30am – 重构实验室检测网络提升疫病监测效能, 陈西钊,灵羽生工(北京)医药科技有限公司
1 高通量检测视角看蓝耳病检测

图 王衡,华南农业大学
一、蓝耳病流行特点
①蓝耳病毒核酸阳性场广泛存在;
②疫苗毒核酸阳性场占据一定比例;
③美洲型第一谱系优势明显;
④欧洲型检出日趋升高;
⑤混合感染和毒株(间/内)重组频发。
二、核酸检测目的

三、高通量测序分析重组和混合感染的目的
① 准确鉴别野毒和疫苗毒/驯化用毒(免疫/驯化后,排除野毒感染);
② 检测是否有新毒株感染,以排除生物安全管理因素(如果是老病原,提示内部生物安全存在问题;如果是新病原,提示外部生物安全存在问题);
③ 明确感染情况,因为感染情况是猪群从暴发中恢复的关键因素(猪群感染新毒株或同时感染多种毒株会造成较大的影响)。
四、分析蓝耳病活病毒疫苗不同批次间差异(毒株间差异)
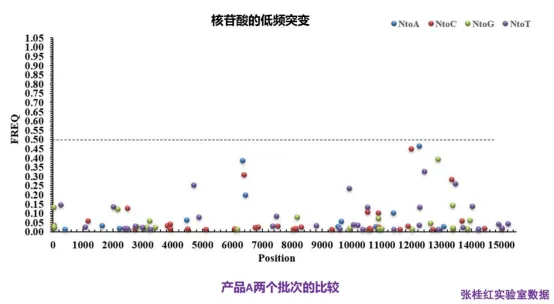
五、小结
高通测序技术在分析蓝耳病中的作用:
① 准确辨认重组;
② 科学判断混感;
③ 为分析毒株间细微差异提供有效工具。
2 流行病学与实验室诊断在猪病防控中的应用

图 何启盖,华中农业大学
一、现场流行病学的精髓(个人观点)
(一)病因的“三间分布”规律
(二)初步疾病(传染病,非传染病)假设(根据发病日龄、症状、鉴别诊断)
(三)正确采样:疾病调查、免疫评估
(四)基于病因(原)特点,风险识别评估与控制
(五)流行病学相关
(六)疾病控制策略可行性分析
二、动物传染病流行对检测方法的新要求
1、近10年来,人和动物传染病数量不断上升
原因:全球生态学变化、交流频繁和贸易增加
2、一种症状可由很多病原引起;很多疾病具有相似症状;临床诊断困难
3、病原微生物感染特点
3.1 多病原混合感染:PRRSV/PCV2 + GPS/Pm/APP
3.2 多亚型(血清型)感染:PRRSV (genotype, subtypes), GPS(15血清型), Streptococcus suis, APP (19血清型)。
3.3 新发和再现病原: SADS-CoV, Getah virus,PCV3/4/5?
3.4 未知病原
三、现有检测方法的优点与缺点
1.病原学方法:
病原分离与形态学观察
核酸检测:
针对单一病原或少量病原,如常规PCR.
只针对已知病原;依赖于公布的靶基因序列
四、猪传染病高通量检测方法种类
高通量检测方法:一次可检测很多样品,或,一个样品同时检测很多指标(参数)。
抗体检测:ELISA
抗原检测:蛋白质芯片(protein chip) 、液相芯片:不同颜色微球上包被抗体,如Luminex技术检测多因子;
核酸检测:基因芯片(gene chip) 病毒/细菌宏基因组(metagenomics)
五、国家“十三五”重点研发计划(2016YFD05007)部分研究成果
1. 混合感染鉴别检测方法

2.基因(蛋白质)芯片

3. 未知病原识别技术
病毒宏基因组数据分析
病毒基因组数据库
宿主基因组数据库
宏基因组平台建立
细菌宏基因组数据分析
细菌耐药蛋白
用于新发病毒(变异株)鉴定
如:新型PEDV
六、本实验室研究进展
1、水中ASFV富集与检测技术(Front.Vet.Sci,2022)。
2、免分离的ASFV病毒基因组测序技术(Front.Vet.Sci,2022)
3、病毒宏基因组学技术与二/三代测序技术(未发表)
4、猪繁殖与呼吸综合征病毒多重PCR检测技术(Viruses, 2023)
5、猪细小病毒2、3、6亚型多重PCR方法
6、细菌16s-rDNA检测技术(洪水中细菌检测)(畜牧兽医学报,2023
七、现场流行病学和实验室诊断技术应用:
1、猪伪狂犬病净化
(1)材料准备阶段:疫苗和检测试剂
(2)抽样调查阶段:确定野毒感染率高低(˂10%;10%-20%;˃20%),确定根除计划的步骤
(3)加强免疫阶段
(4)检疫淘汰
(5)清群阶段
(6)监测与认证(设立哨兵猪)
(7)维持阶段:不免疫,不感染,不发病。
参加“伪狂犬病”净化示范场(创建场)现场评估有感
企业很重视:防非+伪狂犬病净化;组建净化团队(但有些分工不具体)。感谢企业的支持和配合。
需要改进之处:
(1)系统的监测方案和计划
(2)针对伪狂犬病的培训力度不够
(3)风险分析不够
(4)消毒药物没有针对伪狂犬病毒
(5)年度净化评估不全面
(6)疑似病例不剖检和诊断
(7)仍然依赖疫苗
2、非洲猪瘟无疫小区创建
国家级:
第一批:62家
第二批:53家
第三批:51家
省级:很多很多
分析不同生产单元之间可能存在的流行病学相关性;如何阻断传播链条;实验室检测能力;官方兽医与企业之间的互动与协同机制。
3、多层(楼房)养猪模式的疾病防控
陌生环境下的技术服务-越南:2023.7:访问猪场;与越南国立农业大学交流
缅甸仰光:国家兽医诊断实验室;技术培训;访问猪场(2018)
八、挑战与展望
诊断靶标确定
敏感性提高
区分不同基因型
使用方便
价格合理
现场流行病学与实验室检测相结合,避免成为“PCR型”兽医!!
3 猪繁殖与呼吸综合征的流行现状与检测技术(悦洋生物特邀)

图 周智,中国动物疫病预防控制中心
一、PRRS的流行史
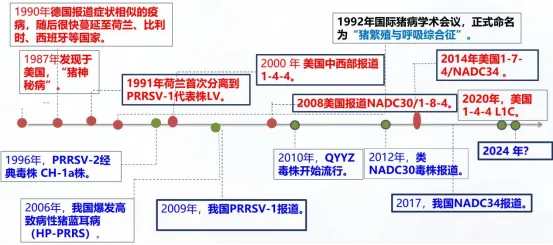
二、PRRS流行现状
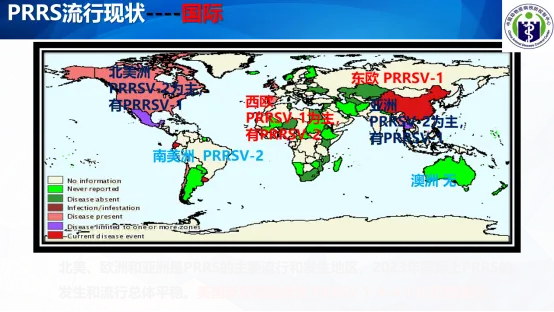
北美、欧洲和亚洲是PRRS的主要流行和发生地区,2023年国际上PRRS的发生和流行总体平稳。美国新型高致病性 PRRSV 1-4-4 L1C仍然流行。
根据美国行业媒体报道,美国2020年10月份开始,出现新型高致病蓝耳毒株,PRRS 1-4-4 L1C, 比以往毒株传播能力更强,全群感染,导致母猪和仔猪的高死亡率。母猪 2-3 周的死亡率可以达到10-20%,保育猪死亡率可以高达50-80%。剖检可见严重的肺部病变外,最引人注目病变还包括胸腺和淋巴结坏死。
据报道目前PRRS 1-4-4 L1C 毒株的传播范围仅限于美国中西部地区(爱荷华州、明尼苏达州及伊利诺伊州)。
到目前为止,我国仍未监测到 PRRS 1-4-4 L1C 毒株的流行存在。
三、我国PRRS的流行现状
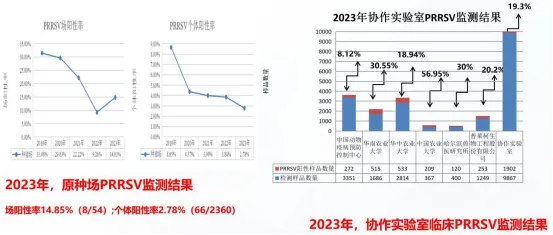
2023年,协作实验室对747株分离毒株的ORF5基因进行测序分型分析,结果显示当前最主要的流行毒株是PRRSV-2 谱系1毒株(包括类NADC30和类NADC34毒株)占比约65.2%(480/747),谱系8毒株(高致病性PRRSV变异株)占比约17.3%(129/747),谱系5毒株(经典PRRSV美洲株)占比约11.8%(88/747),谱系3毒株(类QYYZ毒株)占比约6.7%(50/747)。监测中未发现PRRSV RFLP 1-4-4 L1C毒株存在。
四、类NADC30 PRRSV基本情况
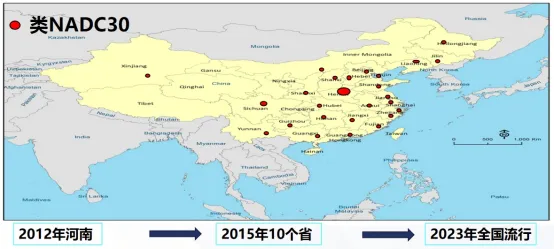
Nsp2基因缺失131个氨基酸:111-aa (323-433)+1-aa (481)+ 19-aa (533-551)
类NADC30 PRRSV主要特征-变异快、基因重组多
五、NADC34 PRRSV 基本情况
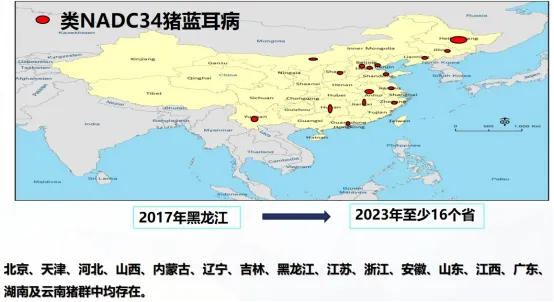
NADC34 PRRSV 基因特征:非结构蛋白NSP2存在100个氨基酸的缺失,遗传演化分析表明,目前我国NADC34毒株与美国Sublineage 1.5 毒株同源性最高,未形成独立分支,表明国内毒株扩散可能和引种有关。
六、欧洲型 PRRSV基本情况
WOAH(原OIE) 参考实验室首次从2006-2009年的临床样本中分离、鉴定欧洲型PRRSV。
2009.9.30提交了国内第一株欧洲型PRRSV(BJEU06-1株)全基因组序列(GU047344)。
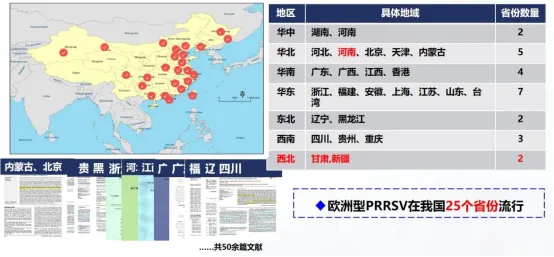
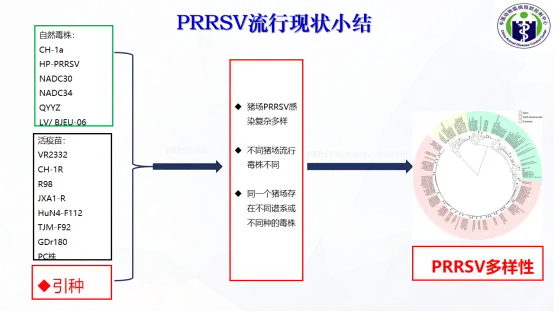
七、PRRSV流行现状小结
八、PRRS诊断策略
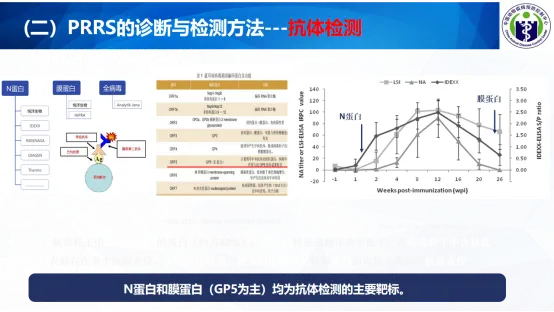
(一)掌握PRRSV感染后体内的病毒与抗体动态变化规律
(二)PRRS的诊断与检测方法
核酸检测(RT-PCR、RT-qPCR)和抗体检测(ELISA)均是PRRSV诊断重要的检测方法,可依据:
国际标准:WOAH 《陆生动物诊断试验和疫苗手册》第3.9.6章《猪繁殖与呼吸综合征》
国内标准 :《猪繁殖与呼吸综合征诊断方法》GB T 18090-2023
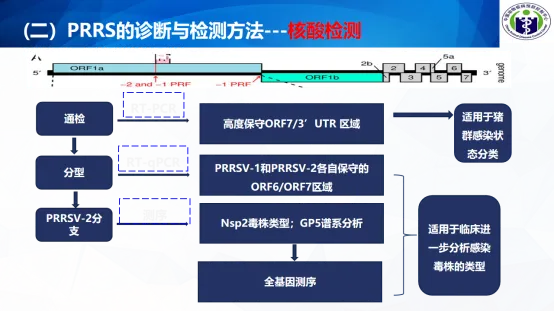
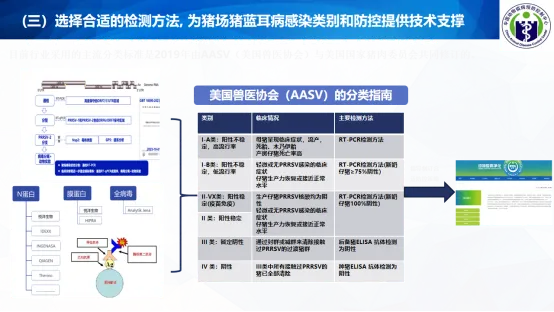
(三)选择合适的检测方法, 为猪场猪蓝耳病感染类别和防控提供技术支撑
4 中国猪圆环病毒的流行与诊断

图 李向东,扬州大学
一、猪圆环病毒简介
圆环病毒是目前已知的最小的病毒,属于圆环病毒科、圆环病毒属。可感染猪的圆环病毒包括PCV1、PCV2、PCV3、和新近出现的PCV4
PCV1为非致病性的病毒;PCV2是断奶仔猪多系统衰竭综合征的主要病原;PCV3可引起猪皮炎肾病综合征;PCV4可引发呼吸道和消化道疾病以及猪皮炎肾病综合征

圆环病毒可以感染猪和野猪,也有报道可感染反刍动物(牛、羊、鹿等)、啮齿类动物(鼠)、犬科动物(犬、水貂、狐狸、貉等)。此外,苍蝇、蚊子和蜱虫也可携带病毒
二、PCV2的流行与诊断
圆环病毒在育肥阶段感染率最高,断奶前仔猪和母猪最低
PCV2a、PCV2b、PCV2d是PCV2流行的主要基因型
在细胞上的分离难度较大
分子方法:PCR和qPCR
免疫分析:免疫组织化学(IHC)、原位杂交(ISH)、原位原位杂交(ISSH)可区分亚基因型
血清学方法:IFA和ELISA,不能用于临床疾病的诊断
IPMA实验证实PCV1与PCV2存在血清学交叉反应。因此,使用间接ELISA方法检测PCV2抗体水平会受到PCV1抗体的干扰
三、PCV3的流行与诊断
PCV3于2016年首次在美国报道,与母猪丘疹性皮炎、肾病综合征和流产相关
2016年,加州大学报道3起临床病例,PCV3感染与猪心肌炎和多系统炎症相关
在美国,PCV3阳性样品最早被追溯至2015年5月。PCV3已在至少9个州流行
PCR检测271份样品,阳性率为12.5%,用ELISA检测83份血清,阳性率为55%
华南农业大学首次在中国检测到PCV3 China/GD2016 株,该毒株与美国PCV3毒株同源性为97.4%-98.5%
断奶仔猪死亡率为6%,临床表现发热、皮肤苍白,腹式呼吸;剖检可见肺水肿、充血;排除其他病原检测
华中农业大学检测全国11个省份35个猪场PCV3流行情况,发现PCV3抗原阳性猪场比率为68.6%(24/35)
南方九省PCV3的阳性率显著高于北方6省
不同类型组织PCV3检出率从高到低依次为肺脏、淋巴结、死胎、肾脏、脑、扁桃体、脾脏、心脏和肝脏
PCV3/PCV2混合感染率为45.8%;PCV3/PRRSV混合感染率62.5% ; PCV3/PCV2/PRRSV混合感染率为33.3%
PCV3流行病学调查研究表明,国内PCV3感染最早被追溯到1996年
依据ORF2基因可将PCV3分成PCV3a、PCV3b、PCV3c 三个不同的分支
PCV3c 是国内流行的PCV3的优势毒株
PCV3与蝙蝠圆环病毒同源性最高
30余篇报道,PCV3的流行病学调查手段主要依赖于传统的PCR和荧光定量PCR方法
由于PCV2/PCV3的流行,我们建立了一种同时检测PCV2/PCV3 的双重荧光定量PCR方法
该方法检测PCV2/PCV3的敏感性,可达2.9/22.5个拷贝数
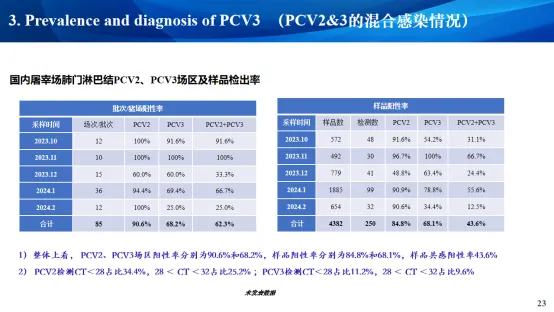
四、PCV2&3的混合感染情况
五、我们开展的组织毒致病力研究
PCV3阳性淋巴结研磨液用于感染3周龄大小仔猪,排除其他外源病原感染
鼻腔和肌注接种,感染21天剖检
大体剖检可见PCV3感染猪的淋巴结出血,肾脏表面由散在的出血点
病理可见淋巴结淋巴组织逸失、出血,间质性肾炎
感染后7天可以检测到病毒血症,鼻拭子/肛拭子均可检测到PCV3核酸
小鼠人工感染PCV3实验:
PCV3可以感染小鼠 ,感染后3-7天出现病毒血症
PCV3 Cap蛋白抗体在感染后第3天转阳,抗体滴度不断上升
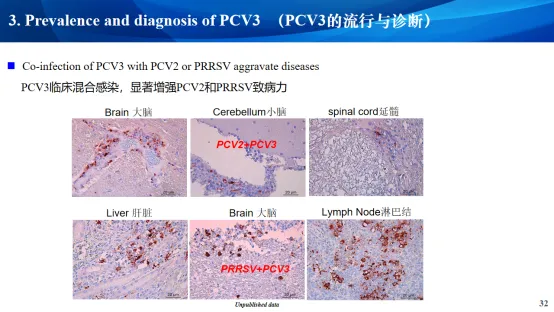
六、PCV4的流行与诊断
2019年4月,我国首次于湖南省发现PCV4,遗传进化上与貂圆环病毒高达66.9%;与其他猪圆环病毒同源性为43.2%–51.5%
PCV4 DNA可在临床中出现呼吸道症状、消化道症状和皮炎肾病综合征等发病猪中检测到。同时,在健康猪群中也可以检测到
PCV4 DNA 在脑、肝脏、脾脏、肾脏、肺脏、淋巴结和小肠中均可检测到
除猪以外,PCV4DNA在犬、狐狸、水貂、貉和奶牛体内可检测到
我们应用建立的PCV1-4 四重实时荧光检测方法检测2016-2020年采自江苏省120份临床样品,有4份阳性
针对江苏省2018年至2020年的临床猪血清进行PCV4的回顾性血清流行病学调查,结果表明,PCV4血清阳性率为1.51%
PCV4首次在PK-15细胞中被拯救出来,动物感染实验证实PCV4可引起不同脏器的病变
5 基因I/II型重组非洲猪瘟病毒的认知和快速检测方法建立

图 赵东明,哈尔滨兽医研究所
一、我国非瘟病毒流行与变异情况
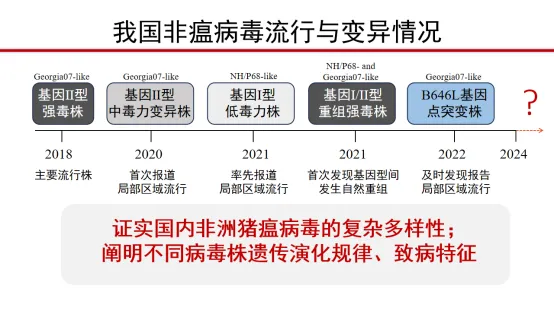
基因型:II型 、 I型 、I/II型重组型
致病性:强毒、中等毒力、低毒力
流行程度:常态化、局部散发、区域流行
二、基因I/II型重组病毒全基因组遗传演化分析
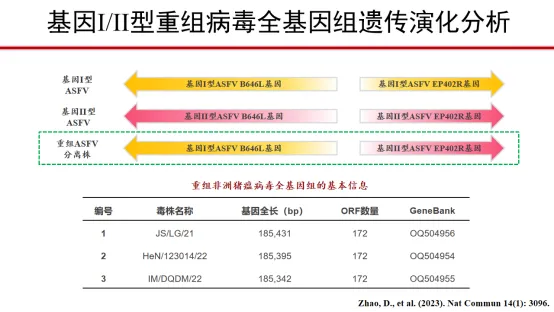
重组分离株全基因组成:
10个基因I型同源片段和10个基因II型同源片段,呈不连续性交叉式排布。
三、基因I/II型重组病毒致病力
高致病性;
急性临床症状;
高死亡率;
强传播能力。
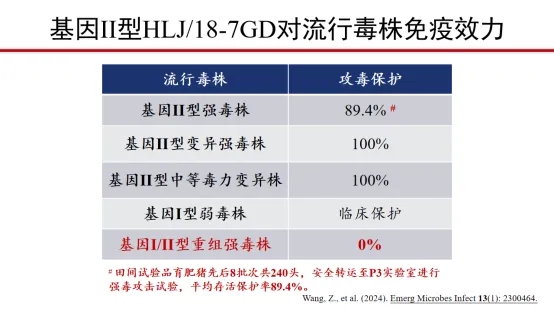
四、基因I/II型重组病毒对疫苗研发提出新挑战
HLJ/18-7GD对基因II型毒株保护好,攻毒后免疫猪无体温升高。
HLJ/18-7GD对基因I型/II型重组强毒株不保护,攻毒后免疫猪体温升高,10天内全部死亡,与对照组无明显差异。
五、基因I型重组、I型弱毒、II型毒株三重鉴别qPCR
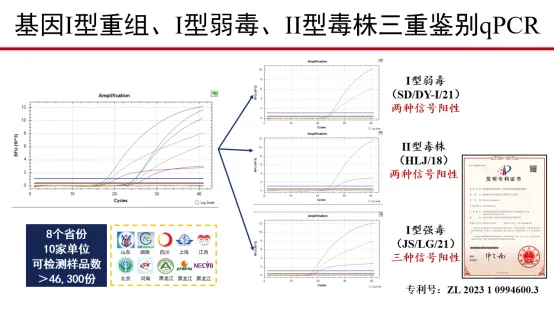
六、基于高通量技术的检测平台建设
非洲猪瘟病毒检测
病毒基因组序列测定
基因组变异分析
其他病原检测
未知病原发现
获得全基因组的样本:
非洲猪瘟病毒:1200株;
鸡疱疹病毒:2株;
马疱疹病毒:4株;
流感病毒:7株;
猪德尔塔冠状病毒:10株;
猪蓝耳病毒:80株。
进行细菌分型鉴定的:
猪链球菌:50株,副猪嗜血杆菌1株
宏基因测序样本:20个
七、小结
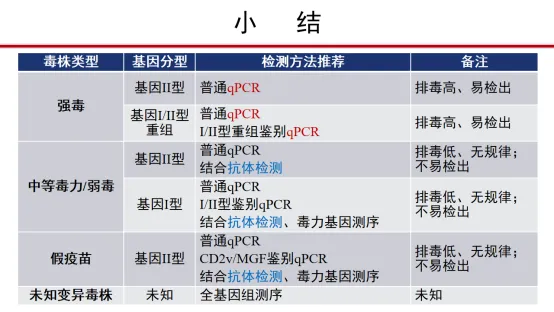
单一检测方法很难确诊:核酸+抗体+测序+病毒分离
QPCR方法结合部分基因测序
抗体检测:尤其是弱毒株感染
病毒分离培养:国家非洲猪瘟参考、专业、区域实验室
流行毒株的新变异情况及时掌握
6 重构实验室检测网络提升疫病监测效能

图 陈西钊,灵羽生工(北京)医药科技有限公司
一、实验室检测的分类
本质上,实验室检测大致分为以下几类
国家检测:牲畜调运、防疫检查
日常监测:免疫效果评估,感染压力监控,感染预警
应急检测:人/车/物入场,发病诊断(烈性病早期确诊)
二、中国现有庞大的实验室体系
动物疫病防控机构实验室
中央-省级-市级-县级
养殖集团区域实验室
服务机构实验室
大专院校
动保企业
饲料企业
第三方
三、主要问题:职能重叠,工作重复,效能低下
目前的实验室检测,更多的是“国检”“监测”
从动物疫病防控角度看,目前的实验室从事的或更适合于动物疫病的“监测”
畜禽异地调运
免疫效果评估
感染压力监控
四、动物疫病防控之路还有“最后一公里”
对于临床上突发的异常动物的快速确诊(尤其是非瘟),人/车/物的入场决策,不能等,常规的“采样送检”则显得力不从心
根据实验室检测的复杂性,最快可以在1-2天内生成结果,并将报告传回给临床兽医,然后,临床兽医分析测试结果并采取对应措施。实际上,由于运输、实验室容量、测试处理和数据共享等原因,从提供样本到交付结果可能需要长达一周的时间。
如同分级诊疗,分级检测刻不容缓,势在必行
“送样品,收报告”的检测模式存在着诸多弊端
五、重构网络,分级检测,提升效能
行业引领-国家级兽医诊断实验室
新型诊断技术研究
诊断检测技术国家/行业标准制定/修订
标准物质制备与供应
重大动物疫病/外来病诊断技术攻关
省级实验室能力验证
六、补短板-现地检测防疫“最后一公里”高效检测网络的最核心组成部分
现地检验/即时检测(POCT,point-of-care testing)
在采样现场进行的、利用便携式分析仪器及配套试剂快速得到检测结果的一种检测方式。POCT含义可从两方面进行理解:
空间上,在养殖地进行的检验;时间上,可进行“即时检验”。
通常不一定是专业化验员来进行,能快速得到检验结果
七、POCT检测
操作简便:在资源有限或专业人员短缺的环境中能发挥作用。
快速:能够在采样现场快速得到检测结果,极大地缩短样本周转时间
信息化管理:POCT设备可与信息系统集成,实现数据的实时传输和分析,有助于提高现场诊断质量和效率
信息化管理:POCT设备可与信息系统集成,实现数据的实时传输和分析,有助于提高现场诊断质量和效率
灵羽智慧基站TM
现地30分钟快速核酸检测工作站,一键式操作
灵羽生工(北京)医药科技有限公司
最新发布