
猪萨佩罗病毒(Porcine sapelovirus, PSV)属于小RNA病毒科萨佩罗病毒属,是一种无包膜单股正链RNA病毒。与其他猪肠道病毒相似,PSV主要通过粪-口途径传播,也可通过接触和气溶胶传播。仔猪对该病毒易感,其可引起仔猪神经系统、呼吸系统、消化系统等的功能紊乱,严重时可导致猪死亡,不同毒株之间毒力与组织嗜性存在差异。临床中PSV常与猪捷申病毒、猪流行性腹泻病毒、猪库布病毒等多种病毒混合感染,使其临床症状复杂、诊断难度增加,从而加快病毒传播速度。此外,PSV存在的基因重组现象及跨种传播风险,对养猪业造成潜在威胁。目前已有核酸水平、蛋白水平、血清学等多种检测方法可用于PSV的实验室检测,已有多种细胞系可建立其体外感染模型,用于该病毒的相关研究。截至目前,PSV的研究主要集中于流行病学研究及其分离鉴定,有关PSV感染和致病机制研究较少且无商品化疫苗和有效的抗病毒药物。笔者对PSV的病原学特征、流行病学、致病机制、临床防控等方面的研究进展进行综述,以期为PSV的进一步防控研究提供理论依据。
猪萨佩罗病毒(Porcine sapelovirus, PSV)是目前已知最小的动物RNA病毒之一,可感染各年龄段猪,但主要侵害10~20周龄仔猪。临床中PSV对猪的神经系统、呼吸系统、消化系统等造成不同程度损伤,严重时可导致猪死亡。病猪愈后生长速度减缓,甚至出现僵猪。由于PSV的临床症状不典型且常与多种病毒混合感染,临床诊断中常忽视了该病毒的存在,导致其大规模传播,对中国养猪业造成潜在的威胁。目前该病毒在世界各国广泛流行,Li等发现中国猪场中PSV血清阳性率高达80.23%。此外,PSV不仅感染猪,还可感染犬、猫、牛、猴等多种动物,具有跨物种传播的风险,需引起高度重视。
1 PSV病原学特征
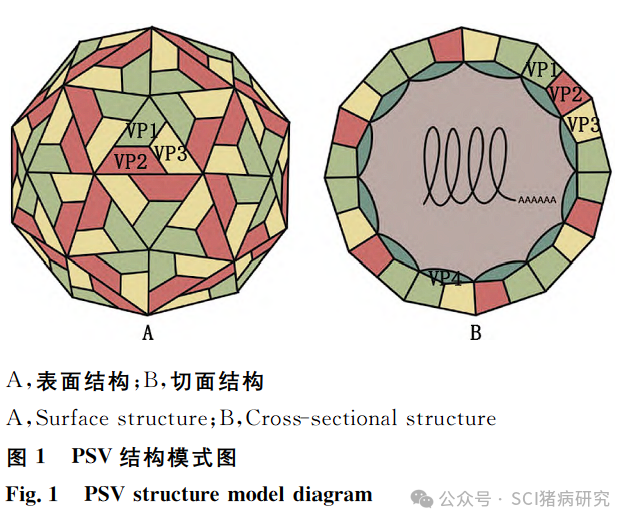
PSV属于小RNA病毒科萨佩罗病毒属,是一种无包膜单股正链RNA病毒。由于该病毒最初在猪肠道中发现,根据其形态结构曾被分类至肠病毒属,称作猪肠道病毒8型。电子显微镜下,PSV呈二十面体立体对称结构,直径为25~30nm。成熟的PSV病毒粒子可在环境中稳定存在,能抵抗酸性pH,但在高温、脂质溶剂和一些消毒剂的作用下不稳定,次氯酸钠或70%乙醇可有效灭活该病毒,不同毒株间灭活条件略有不同。
与其他肠道病毒相似,粪-口传播是PSV最常见的传播途径。此外,该病毒粒子也可通过污染物接触传播。研究显示,当空气中粒径为2.0~2.5μm 的气溶胶浓度>106个/m3时,PSV的检出率增高,增加了该病毒气溶胶传播风险。另有报道称猪群死胎的肠道内容物中也检测到PSV,提示该病毒也可能经胎盘垂直传播,但目前无相关报道证实。PSV结构模式图见图1。
PSV基因组大小约为7.5kb,由5′-非翻译区(untranslated region, UTR)、中间编码区、3′-UTR和聚A尾(poly-A tail)组成(图2)。中间编码区仅含一个大的开放阅读框(open reading frame, ORF),编码一个长约2330ku的多聚蛋白,该蛋白结构与其他小RNA病毒结构一致,完成编码后被自编码的蛋白酶切割成1个前导肽(leader peptide, L)、4个结构蛋白(VP1、VP2、VP3和VP4)和7个非结构蛋白(2A、2B、2C、3A、3B、3C和3D)。
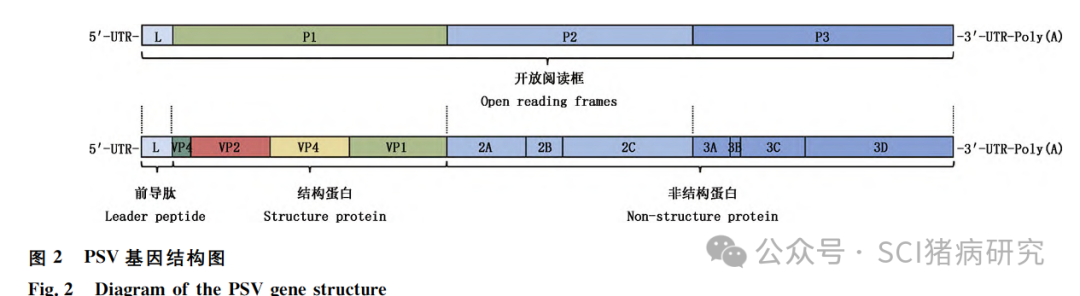
PSV独有的L蛋白是区别于肠病毒属的标志。PSV的4个结构蛋白共同构成病毒衣壳,VP1、VP2和VP3共同构成病毒衣壳,VP4位于病毒衣壳内部。由于VP1为PSV诱导机体产生中和抗体的关键蛋白,且不同毒株之间VP1具有高度变异性,因此,VP1是分析PSV不同毒株间遗传变异关系的最佳蛋白。目前没有关于该病毒VP2、VP3和VP4功能的相关介绍。PSV的非结构蛋白通常参与病毒复制。有研究表明,2A蛋白是诱导线粒体凋亡通路的重要因子,该蛋白中与蛋白酶活性相关的保守残基H48、D91和C164对其诱导的细胞凋亡至关重要。3Cpro蛋白通常有剪切活性,PSV通过3Cpro蛋白降解黑色素瘤分化相关基因5(melanoma differentiation associated gene 5, MDA5)和TANK结合激酶1(TANK binding kinase1, TBK1),并通过Caspase途径剪切线粒体抗病毒信号蛋白(mitochondrial antiviral signaling protein, MAVS)来阻断宿主抗病毒免疫。目前,关于PSV各蛋白组分在病毒感染中作用机制研究较少,其功能有待进一步研究。

2 PSV流行病学
19世纪60年代,PSV于英国首次发现,国内于2009年首次发现并于2011年首次分离该病毒。现有相关文献证明PSV在中国出现的时间可追溯至1993年。此外,韩国、法国、美国、印度、意大利等国家也先后发现并报道了PSV的感染。2018年,赞比亚147份粪便样本显示,未断奶仔猪和育肥猪的PSV感染率分别为36.2%和94.0%。2021年,法国科西嘉岛908份猪粪便样本中PSV的检出率为62.0%。近年来对全球PSV的调查显示,该病毒流行范围扩大且检出率不断增加。
在中国发现PSV后的几年间,兰道亮等、陈俊伟等分别对中国华东、华南部分地区PSV的流行病学进行调查,结果显示其阳性率分别为17.2%和18.12%。2016年后,四川、上海、广东、湖南、江西、宁夏等多省市对PSV展开流行病学调查,结果显示,其阳性率为17.7%~61.25%,且随时间推进整体呈上升趋势。该结果可能受样品采集时间、养猪场的规模及区域性养殖管理政策等因素影响。此外,吴青青在其回溯性研究中发现,1993年的临床样品中存在PSV阳性,提示该病毒可能已在中国存在并传播了几十年之久。
国内多地区对PSV的流行病学调查综合显示,哺乳仔猪及保育猪对该病毒易感。西班牙学者Vilar等研究显示,断奶仔猪对PSV易感,而韩国学者Bak等指出各年龄段的猪对PSV均易感。该研究结果提示不同毒株PSV对猪群易感性差异可能与地理位置、畜牧养殖环境及区域内所流行的毒株相关。李本强等和李倩倩于中国分离出的PSV毒株多与日本、韩国等亚洲国家同源性较高。吴青青分离的毒株与德国、意大利等国家所流行的毒株同源性较高。与多种全球流行性病毒相似,PSV不同毒株之间存在基因重组现象,这将大大提升其防控难度。随着对PSV研究的不断深入,基于其P1基因将该病毒分为PSV1和PSV2两种分型。其中PSV1在全球范围内广泛流行,而PSV2仅在匈牙利和中国检出并报道。该分型的完善为后续开展大规模的流行病学调查奠定基础。
截至目前,PSV已从家猪、野猪、猴、鸭等多个物种中成功分离,且PSV特异性基因片段也在蝙蝠、猫、牛、犬、鸽、海狮等物种中检测到。随着病毒分离技术的成熟,PSV毒株的分离率逐渐增高。目前尚无PSV感染人的相关报道。
3 PSV病理学观察
虽然在母猪中未观察到明显的临床症状,但有研究表明,在PSV显性感染的哺乳仔猪中出现不同程度的水样腹泻、脱水等症状。除对消化系统的影响外,PSV还可引起活动障碍、共济失调、精神迟钝、对环境刺激反应减弱等一系列精神症状,部分猪存在无症状感染。临床中,PSV感染常与其他病毒发生混合感染,如猪捷申病毒(Porcine teschovirus, PTV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)、猪库布病毒(Porcine kobu virus, PKV)等,混合感染引起的复杂临床症状致使PSV诊断难度增加且易被忽视,从而造成PSV的传播与流行。
对PSV自然感染猪的病理学调查显示,PSV主要感染脑、肺脏和肠道,引起脑炎、间质性肺炎及严重肠炎。病变主要见于中枢神经系统(central nervous system, CNS),与其他嗜神经病毒感染一致,特征为亚急性、多灶性和非化脓性脊髓灰质炎、脑脊髓炎,伴硬脑膜点状出血和充血。在临床肺炎病例中可见肺叶的实质性病变、多灶性出血、红细胞浸润肺间质和肺泡及肺泡壁变薄;小肠中常见充血,组织学上伴有肠绒毛明显丧失和固有层出血。上述症状与猪肠道病毒(Porcine enterovirus, PEV)、猪冠状病毒(Porcine coronavirus, PCoV)、猪轮状病毒(Porcine rotavirus, PoRV)等感染后引起的病理变化相似。
研究显示,PSV不同毒株对不同器官表现出不同的亲和力,如PSV-csh和PSV-G5主要影响神经系统,JXXY-a2株在体外具有广泛的细胞嗜性,但该毒株在仔猪体内主要感染肠道并有效复制引起腹泻。GS01可引起新生仔猪的炎症反应并引起严重腹泻。除区间养殖环境及其主流养殖品种的差异外,不同毒株引起宿主的不同病理变化可能与其基因组关键位点发生的变化相关。
4 PSV致病机制
目前对于PSV感染及致病机制的研究还不够深入。唾液酸是细胞表面丰富的碳水化合物部分,是多种病毒的受体,Kim等研究表明,细胞表面GD1a神经节苷上的α-2,3唾液酸连接末端可作为PSV结合和感染的受体。此外,大量研究显示,部分嵌合抗原受体、跨膜糖蛋白及免疫球蛋白等可作为小RNA病毒感染细胞的受体,而口蹄疫病毒(Foot-and-mouth disease virus, FMDV)的相关研究提示,病毒入侵宿主可能通过多受体协同作用,这为进一步研究PSV的入侵机制提供了思路。
不同的小RNA病毒会通过多种途径进入宿主细胞,如网格蛋白介导的内吞作用、细胞膜穴样内陷及脂筏。Zhao等研究显示,PSV通过脂筏介导的内吞作用进入细胞,病毒粒子进入细胞依赖于微酸环境,提示该病毒易感部位可能与此性质相关。Zhao等研究表明,PSV进入细胞的过程还需动力蛋白、PI3K激酶及Rab7和Rab11的参与,根据Rab蛋白家族的功能分类,提示该病毒进入细胞发生在内吞作用的晚期。
肌动蛋白参与了病毒的复制过程,Zhao等研究指出肌动蛋白聚合抑制剂的使用促进了PSV的复制,提示肌动蛋白的重构可能与PSV的复制相关。随后通过蛋白组学研究了PSV感染细胞过程中宿主蛋白的表达变化,其中与宿主天然免疫相关的蛋白,如IFIT5、ISG15表达量显著升高,而SPP1、VCL水平的升高提示病毒感染后可能引起细胞骨架结构的改变,此外,SDC1作为一种新型宿主蛋白,其表达量与病毒复制水平、病毒滴度呈正相关,提示该蛋白在调节PSV复制过程中起重要作用,这为进一步研究PSV的感染机制提供了依据。
先天免疫反应也参与PSV的感染。体内试验显示,PSV感染仔猪后激活体内Th1和Th2型细胞免疫反应。体外试验显示,PSV感染肠上皮细胞后诱导Ⅰ型干扰素(IFN-Ⅰ)的表达,进而激活先天免疫受体的3条通路及相关的干扰素效应通路。PSV对IFN-Ⅰ(如IFN-β)敏感,然而PSV仅能在部分细胞系中诱导激活IFN-β在RNA水平的表达,这提示PSV可能存在不同组织嗜性或已进化出有效的机制来阻止IFN-β的产生,其2A蛋白在该过程中发挥重要作用。另有研究显示,PSV的3Cpro蛋白可降解MDA5和TBK1,并通过Caspase途径剪切MAVS以阻断宿主抗病毒免疫。
5 PSV实验室检测
由于PSV临床症状不明显,且常与其他病毒发生混合感染,因此,实验室检测是最准确、高效的检测方式。早在英国分离该病毒时,免疫组化已可用于该病毒的检测。随后,印度也使用该方法对不同年龄自然感染猪的各组织进行了检测。另有研究分别通过PSV VP1和3C蛋白包被抗原,建立间接ELISA检测方法用于病毒的检测。此外,美国通过原位杂交技术在中枢神经系统中检测到了PSV,随后,该检测方法在中国成功建立。核酸水平的检测方法较为丰富,如反转录PCR(RT-PCR)、反转录巢式PCR(RT-nested PCR)、实时荧光定量PCR、逆转录环介导等温扩增法(RT-LAMP)及多重RT-PCR法已用于PSV的检测。普通的RT-PCR手段耗时较短,但在样品处理过程中易发生污染,增加了结果假阳性的可能性。因此,选用优化后的检测方法会使检测结果更具有特异性、敏感性和快速性等优点,且不易与其他常见病原体发生交叉反应。对于常与其他病原体混合感染的PSV而言,该检测方法存在更为突出的优势。
活体样本通常采集鼻咽拭子、粪便,尸体则选用脊髓、大脑、肝脏、脾脏、气管、肺脏、肠等用于PSV感染的检验。Kumari等从猪死胎的肠道内容物中检测到PSV,提示死胎及胎盘或可用于送检。目前尚无相关报道证明PSV能从心脏、肝脏和肾脏中检出。
PSV体外可感染人肝癌细胞PLC/PRF/5细胞系、人肝癌细胞HepG2/C3a细胞系、非洲绿猴肾细胞VeroE6细胞系、猪睾丸(swine testis, ST)细胞系、人胚肾细胞293T细胞系和幼年叙利亚地鼠肾(baby hamster Syrian kidney, BHK-21)细胞系及部分猪肾细胞来源的细胞系,并引起细胞病变效应(cytopathic effect, CPE),其中猪肾细胞系中如EFN、PK-15、IBRS-2和LLC-PK普遍易感,感染后通常引起细胞变圆、皱缩、脱落并常伴有胞质颗粒增多等现象。但在人肝癌细胞Huh7细胞系、人肺腺癌细胞A549细胞系、人胚肺成纤维细胞WI38细胞系、海拉细胞系、人喉表皮样癌细胞Hep2c细胞系及人结直肠腺癌细胞HCT15细胞系中未诱导CPE。实验室培养的PSV一般利用免疫荧光技术进行测定。
6 PSV防控
研究表明,PSV免疫母猪后的母源抗体不能有效保护仔猪免受PSV感染,且母猪子宫和阴道内接种阳性血清会导致胚胎及胎儿感染。与同为小RNA病毒科的A型塞内卡病毒(Senecavirus A, SVA)相似,由于PSV感染和致病机制还不清晰,目前尚无PSV的商品化疫苗和有效的抗病毒药物。因此,猪感染该病毒后的治疗方式主要为对症治疗,现有研究提示中药组方或可用于缓解其部分临床症状。规范养殖、科学管理、严格的生物防控是预防PSV感染最有效的措施。
尽管PSV在世界各地的猪群中广泛分布,但有关其进化模式、感染机制及免疫逃逸的详细信息尚不清楚。且PSV感染流行率的精确数据及该病毒的遗传多样性仅在有限的几个国家明确报道过。近期研究发现,PSV毒株间可能存在重组现象,提示应加强该病毒毒株间遗传变异的监测。此外,该病毒与其他肠道病原体联合感染的关系尚不清楚,这大大增加了PSV致病性研究的难度。因此,除科学养殖外,还应着力探究该病毒致病机制,积极研发相关疫苗及抗病毒药物,为PSV及相关病毒的防治提供参考依据。