
多家公司在研的伪狂犬亚单位疫苗已经进入临床试验阶段,离上市越来越近了。继圆环亚单位、猪瘟E2亚单位疫苗成功上市之后,伪狂犬亚单位是否能够再次刷新大家对亚单位疫苗的期待,在伪狂犬防控和净化发挥独特的作用呢?
为此,我们翻译了张改平院士团队2020发表的一篇文章,对该类疫苗的临床保护效果跟大家做个简单的介绍。
本文看点:
1. 保护效果:gD或gB+D免疫一次的仔猪用106.6TCID50的PRV-HNLH突变毒株攻毒后,没有出现临床症状、发热和排毒、组织(大脑、肺脏)带毒。相反,gB或灭活苗免疫仔猪出现临床症状、发热和排毒、组织(大脑、肺脏)带毒。
2.中和抗体:gB免疫仔猪中没有诱导出中和抗体,而gD免疫仔猪的中和抗体维持在2的5次方以上,一直持续至12周,远远高于全病毒灭活苗组(图5d)。这一发现再次提醒我们,评估伪狂犬活苗或者灭活苗免疫效果,使用gBELISA抗体试剂盒的局限性。在疫苗抗体监测方面,可能更需要的gD抗体的ELISA试剂盒。
3. 细胞免疫:淋巴细胞增殖试验和IFN-γ水平显示,gB组的T细胞的免疫反应比其他组更强烈(图5c)。细胞免疫作为活苗免疫的主要保护性机制,在伪狂犬临床症状的消除方面发挥重要的作用,但其评估一直存在技术性难度。
4. 本研究提示,gB抗原能够刺激产生强烈的细胞免疫,而gD抗原诱导产生很高的中和抗体,gB+D二价疫苗的表现可能更优,可以作为控制PRV的主要候选疫苗。
gD亚单位疫苗一次免疫就能抵抗伪狂犬病毒感染
A single dose glycoprotein D-based subunit vaccine against pseudorabies virus infection
全文链接:
https://xueshu.baidu.com/usercenter/paper/show?paperid=183b04y0jh5s02s03a2808q0t0470176&site=xueshu_se&hitarticle=1
摘要
伪狂犬病(PR)也被称为奥耶斯基氏病,是由伪狂犬病病毒(PRV)引起的猪最重要的传染病之一,给全球养猪业带来巨大的经济损失。2011年后,PRV变异株的出现导致现有的商品苗的效力急剧下降。为了开发一种能够预防PRV传播的更有效的疫苗,将近期分离的PRV毒株上的糖蛋白B(gB)、糖蛋白C(gC)和糖蛋白D(gD)在杆状病毒系统中进行表达,并在小鼠和仔猪身上测试了它们的保护效力。免疫gB、gC和gD疫苗的小鼠的中和抗体滴度(中和抗体)在免疫后28天达到峰值,然后缓慢下降。用gD免疫的小鼠的NA明显高于其他组。在用5 个LD50的PRV-HNLH突变毒株攻毒后,gB和gD免疫小鼠的存活率分别为100%和87.5%,明显高于gC免疫组(50%)。gD和gB+D免疫的仔猪在免疫后7天出现最高水平的NA。这两组的仔猪在用106.6TCID50的PRV-HNLH突变毒株攻毒后,没有出现临床症状、发热或排毒的现象。组织病理学和免疫组化显示,gD和gB+D免疫组的病理损伤和病毒载量明显减少。此外,gD一次免疫诱导的中和抗体的持续时间可以维持4个月之久。本研究表明,基于gD的亚单位疫苗可用于有效地控制PRV。
1简介
PR(伪狂犬病)或奥耶斯基氏病是由伪狂犬病毒(PRV)引起的一种传染性的病毒疾病,其特点是出现各种临床症状,包括呼吸道症状和生长缓慢,母猪流产和种猪不育,导致全世界养猪业的巨大经济损失。PRV属于疱疹病毒科疱疹病毒甲亚科,为双链DNA病毒,其143 kb的基因组至少含有72个基因,毒力相关基因如TK、gC、gE、gG和gI,被缺失并用作基因标记的疫苗,用以区分感染和免疫动物。大多数商业化的疫苗都遵循这一策略,如缺失了gE的Bartha-K61疫苗。然而,自2011年7月以来,在中国的许多地区,免疫了Bartha-K61疫苗的养殖场重新被伪狂犬感染,这说明了传统疫苗对新出现的PRV变异株的效力不足。
在PRV的囊膜上,由UL27、UL44和US6基因编码的gB、gC和gD是最丰富的糖蛋白。另外,gB和gD对病毒和细胞膜或囊膜的融合是必不可少的,这也是α-疱疹病毒进入宿主细胞的必要条件。gC在融合过程中也起着重要作用, gC使病毒附着在细胞表面的硫酸肝素上,然后与其受体结合并置换C端结构域(PFD)以激活gB的融合。最后,在gH和gL异二聚体的帮助下完成融合。
已经证实,对于gB和gD产生的抗体可以保护猪免受PRV的致命感染。此外,gC也显示出对病毒的感染具有良好保护作用。然而,由于20世纪90年代基因工程技术的限制,从PRV病毒中获得这些蛋白的成本太高,劳动强度大,无法用于商业生产。
近年来,具有高纯度和免疫原性的亚单位疫苗在一些病毒疫苗中得到了大量的研究和应用,如乙肝、人乳头瘤病毒、猪圆环病毒2型和经典猪瘟病毒等。然而,很少有针对PRV的亚单位疫苗被开发。
为了开发更有效的针对于PRV变异株的疫苗,我们在Bac-to-Bac杆状病毒表达系统中表达了gB、gC和gD,并评估了它们的免疫原性和有效性,包括中和抗体(NA)滴度、存活率、临床症状、病毒载量、排毒和病理以及细胞因子的产生。结果显示,gB可以有效的诱导NA,并对小鼠的致命性感染提供全面保护,但对猪则没有;gD可以诱导有效的NA,并明显降低小鼠和猪的感染率。总的来说,我们的结果表明,gD亚单位疫苗可能是控制PRV的一个有希望的候选疫苗。
2材料方法
2.1. 病毒和细胞
Vero细胞(本实验室存放),在含有10%的胎牛血清(FBS;赛默飞)的DMEM培养基(索莱宝)37 C的5% CO2培养箱中培养。Sf21细胞(本实验室存放),在Sf-900 II无血清培养基(SFM,赛默飞)中,28℃振荡培养箱中培养。PRV毒株HN-LH(本实验室存放),在动物实验中被证明为高致病性的PRV毒株,一个新的系统发育分析中的变异毒株。
2.2. 表达质粒的构建和蛋白的制备
完成基因测序后,PRV毒株HN1201(GenBank: KP722022)的gB、gC和gD基因的DNA序列由生工生物公司合成。通过PCR扩增gB、gC和gD基因,然后设计gp67信号序列和6×His标签,在每个片段的N端和C端设计了6个引物(表1)。扩增产物通过BamH I和Xho I酶切后连接到pFastBac I载体中,并命名为pFastBac-gB、pFastBac-gC和pFastBac-gD。
所有的蛋白质都用Bac-to-Bac 杆状病毒表达系统进行表达。将重组质粒pFastBac-gB、pFastBac-gC和pFastBac-gD转化到大肠杆菌DH10Bac感受态细胞中,构建重组杆状病毒。重组杆状病毒用来感染sf21细胞以生产大规模可溶性蛋白。三种蛋白通过His标签蛋白纯化树脂(GE)纯化,然后通过预填充柱(GE),通过免疫印迹试验、凝胶电泳和质谱分析,验证这三种蛋白的纯度。
2.3. 小鼠疫苗免疫和攻毒
四周大的雌性巴比赛小鼠(n = 72)随机分为9组,经过适应后,两组用等量的PBS和伪狂犬全病毒灭活苗(PCIV,武汉科前生物公司)进行免疫,gB、gC和gD组分别用30ug gB、gC和gD蛋白免疫;gB+D组用30ug gB和gD蛋白(各15ug);gB+C组用30 ug gB和gC蛋白(各15ug);gC+D组用30ug gC和gD蛋白(各15ug);gB+C+D用30ug gB、gC和gD蛋白(各10ug)。所有组均在0和14天进行两次免疫,并在35天时用PRV HN-LH株(5 LD50/每只老鼠)进行攻毒。每周采集尾静脉血样,攻毒后,每天观察小鼠,对其临床症状进行评分:1、免疫点瘙痒,强烈抓咬;2、烦躁不安,毛皮杂乱;3、自残行为,注射点皮肤被咬掉,精神萎靡;4、奄奄一息或死亡。
2.4. 仔猪疫苗免疫和攻毒
将未感染猪伪狂犬病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、经典猪瘟病毒(CSFV)和猪圆环病毒2型(PCV-2)的10周龄猪(n = 32)随机分为6组(五组n = 6,对照组n = 2),通过耳标追踪。实验期间,每组都被放置在一个单独的栋舍。适应一周后,gB组注射25ug gB;gD组注射25ug gD;gB+D组每头注射25ug gB和gD(各12.5ug);PBS组和PCIV(灭活苗)组每头分别注射等量PBS和PCIV。最后两头猪作为对照组,没有免疫,也没有攻毒。免疫后四周,所有免疫疫苗的猪都用106.6 TCID50 PRV-HNLH毒株的攻毒。
攻毒前,每星期采一次血清样本。攻毒后,每隔一天采一次血清样本,每天观测临床症状和直肠温度,直到攻毒后14日。攻毒后每天收集口咽液(OPF)样本,直至攻毒后14日,用于监测排毒。在攻毒后10天,随机选择所有组别中的三头仔猪,并对其进行安乐死。采集大脑、小脑、扁桃体和肺,一半用4%(w/v)多聚甲醛固定,另一半保存在-80℃。所有血清用猪伪狂犬病病毒gI(gE)抗体检测试剂盒(爱德士) 进行检测。
2.5. 猪体内中和抗体的持久性
四周龄的猪(n = 12),无PRRSV、CSFV、PCV-2和PRV感染,随机分为三个组。在实验过程中,每组被安置在一个单独的房间里,适应一周,颈部肌肉注射中用PBS、gB 25ug/头和gD 25ug/头进行一次免疫,每两周收集一次血清,所有血清用猪伪狂犬病病毒gI(gE)抗体检测试剂盒(爱德士) 进行检测。
2.6. 中和试验
血清样本56℃灭活30分钟,用于在Vero细胞上进行中和试验。将血清稀释2倍,与100 TCID50 PRV病毒在37℃下培养1小时,加入含Vero细胞的96孔板中培养2天。通过IPMA与PRV-gE单克隆体(本实验室保存)观察细胞病变效应(CPE),在50%的孔内中和病毒的最高稀释倍数。
2.7. 淋巴细胞的分离和刺激
根据产品说明书,用羟丙基甲基纤维素(索莱宝)从攻毒前7天和攻毒后4天的肝素钠的血清样本中分离出淋巴细胞。使用台盼蓝染色对细胞进行计数,评估细胞活力。将总共106个细胞/孔一式三份免疫到96孔板中,用100 TCID50 PRV病毒或等渗DMEM刺激,在37摄氏度下培养72小时,加入CCK-8(10ul/孔),在37摄氏度下再培养2小时,在450nm处测量吸光度。T淋巴细胞增殖用刺激指数(SI)表示,等于未刺激孔的平均读数/DMEM孔的平均读数。
2.8. INF-γ ELISA和排毒
根据提供的说明,使用市售的ELISA试剂盒(索莱宝,中国)检测攻毒前7天和攻毒后4天的血清中的IFN-γ水平。
使用宝生物工程公司的 MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0提取OPF样本的病毒DNA,引物(50-TCCACTCGCAGCTTCT-30和50-GCACGTCATCACGAAGGA-30)进行PCR检测。
2.9. 病毒载量的定量
在无菌条件下,将100毫克的大脑、小脑、肺和扁桃体切成小块置于灭菌的PBS中充分研磨(重量/体积=1:3)。完全研磨后,将组织在PBS中的悬浮液在-20℃冷冻,并在37℃下冻融三次,在4℃下以8000转的速度离心10分钟,收集上清液并通过0.22um的滤器进行过滤。使用宝生物工程公司MiniBEST Universal GenomicDNA Extrac-tion Kit Ver.5.0提取样本的DNA,于-20℃保存,用引物(50-TGCAGCTACACCCTCGTCC-30和50-TCAAAACAGGTGGTTGCAGTAAA-30)扩增出UL54片段,大小为65bp。荧光定量PCR是使用罗氏FastStart Universal SYBR green master(ROX)试剂进行的快速实时荧光定量PCR。
2.10 组织病理和免疫组化
每组每头猪抽取三份有代表性的样本,经4%甲醛固化的组织中切下,并处理成小块。根据说明书将大约3-4um厚的切片用苏木素-伊红染色法进行染色。
每组每头猪的三个组织切片进行脱蜡和清洗,然后在3%的H2O2中保持20分钟,然后在37℃下用10%的马血清阻断1小时。切片用PBS洗三次,在PRV-gD单克隆抗体10F7(PBS中1:200稀释;实验室储存)中孵化30分钟,然后4℃过夜。然后,用PBS洗三次以去除多余的抗体,并在37℃下用辣根过氧化物酶结合的山羊抗小鼠IgG(1:500;杰克逊免疫研究公司,115-035-003)孵育1小时;然后用PBS再次洗三次。根据说明书,用增强型HRP-DAB底物显色试剂盒(天根生物,北京,中国)对抗体结合进行可视化。使用DMI3000B徕卡显微镜(徕卡, 韦茨拉尔, 德国)收集图像,每个切片的感染细胞百分比由五个随机的不同视野计算出来的(每个视野计数300个细胞)。
2.11. 实验声明
所有动物实验均经河南省农业科学院动物实验委员会批准,批准号为LLSC1009605和LLSC1009618。所有的动物都中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)的动物伦理学程序和指南,符合良好动物行为的人道关怀。
3结果
3.1. gB、gC、gD的表达和纯化
gB胞外域(A59-N752)中有694个氨基酸,而gC和gD分别覆盖了从P23到Q442和从D19到H352的整个胞外域(图1a)。之前的研究表明,完整的gB可被furin酶切位点(441RRARR445)切分为gBa(gB的未被破坏的一小部分)、gBb和gBc(在furin酶切后形成,并通过二硫键连接在一起)。聚丙烯酰胺蛋白电泳显示,二硫苏糖醇破坏了二聚体键,本研究中表达的gB显示出三条:gBa、gBb和gBc(图1b)。gB用His-tag单克隆抗体(数据未显示)和gB单克隆抗体(图1c)进行蛋白印迹鉴定。表达的gB、gC和gD由Ni-NTA His Bind Resins(GE)纯化,然后通过HiloadTM 16/600 SuperdexTM 200 pg(GE)分子筛,所有的蛋白质在SEC色谱柱中以单峰形式洗脱,经聚丙烯酰胺蛋白电泳分析表明,gB、gC和gD的纯度分别约为98%、95%和98%(图1d、1e和1f),gB、gC和gD通过生工生物工程公司的飞行时间质谱仪分析再次确认。
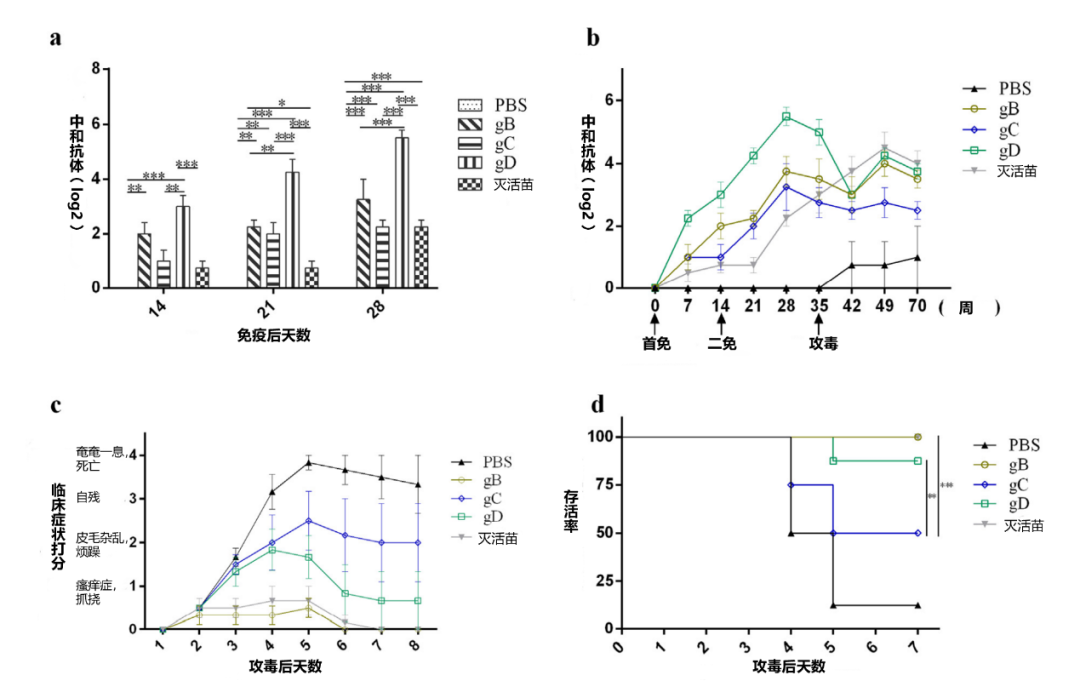
图1.对小鼠用PRV-HN-LH毒株攻毒的保护。分别用PBS、灭活苗、30 ug gB、30 ug gD、30 ug gB + gD(各15 ug);30 ug gB + gC(各15 ug);30 ug gC + gD(各15 ug);以及30 ug gB + gC + gD(各10 ug)各免疫8只小鼠。所有小鼠在1天和14天时进行免疫,在35天用PRV HN-LH毒株攻毒(5 LD50/小鼠)。每星期收集血样,检测不同时间点血清中的中和抗体滴度(a,b)(n = 8)。数据是三个独立实验的代表(误差条代表SEM)。使用GraphPad Prism软件对数据进行分析。定期监测临床症状(c)和死亡率(d)(n = 8)。显著性表示为*p< 0.05,**p< 0.01,或***p< 0.001。
3.2.对小鼠用PRV-HNLH毒株攻毒的保护
为了评估小鼠免疫后对当前流行毒株的保护作用,将30ug的gB、gC和gD注入小鼠体内两次,一次在第1天,另一次在第14天。然后,小鼠皮下注射5 LD50的PRV-HNLH毒株(本实验室证明为新的变异毒株),在二免后的三周末进行攻毒(图1b)。免疫后14天,gB和gD免疫的小鼠的血清中首次检测到中和抗体(图1a)。免疫后21天,gC免疫的小鼠血清中检测到中和抗体。总的来说,gB、gC和gD诱导中和抗体的速度比灭活苗(PCIV)的小鼠快,灭活苗在二免后14天产生中和抗体(图1a)。用gB、gC和gD免疫的小鼠的中和抗体均在加强免疫后14天达到峰值,然后缓慢下降(图1b)。gD组的中和抗体滴度(25.5)明显高于gB组(23.25)、gC组(22.25)和灭活苗组(22.75)(图1a和b)。在5 LD50 PRV-NLH攻毒后,注射gB和gD的小鼠存活率分别为100%和87.5%,明显高于gC组(50%),然而,注射PBS的小鼠只有12.5%存活(图1d)。攻毒后三天,观察到以下临床症状:免疫部位瘙痒与强烈的咬伤,注射部位的皮肤被咬掉并坏死,攻毒后第七天,一只用gD免疫的小鼠死亡,gB组没有小鼠死亡,gC组有4只小鼠死亡,而PBS组有7只小鼠死亡(图1c和d)。总的来说,我们发现在小鼠的保护力方面,gB和gD优于gC。
3.3. 猪的免疫原性和攻毒保护
为了确定gB和gD是否能诱导足够的免疫反应并保护猪免受挑战,我们在猪体内肌注了25ug的gB、gD或50:50的gB和gD的组合。与其他组相比,从免疫后7天到攻毒为止,gD以及gB+gD联合免疫的猪体内检测到的PRV特异性中和抗体的滴度具有统计学意义。然而,单独使用gB免疫的猪的血清中没有检测到中和抗体(图2a)。攻毒后,注射gB和灭活苗的猪的血清中中和抗体滴度缓慢增加,这可能是病毒感染的结果(补充图3)。用gD和gB+D免疫的猪的血清中的中和抗体在维持了8天的高水平后进一步增加,直到14天;gD组猪血清的NA值仍明显高于PBS和gB组(补充图3)。
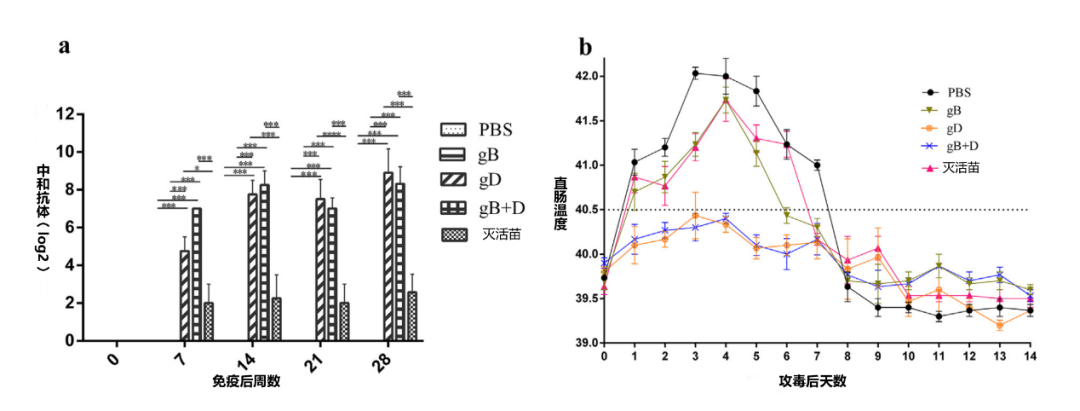
图2. 猪的免疫效果。10周大的猪(n = 32)随机分为6组(每组n = 6,正常组n = 2)。gB组被注射了25 ug gB;gD组:25 ug gD;gB + D组:25 ug gB和gD(各12.5 ug);PBS和灭活苗组:同等的PBS和灭活苗。所有免疫猪只都在第28天时攻毒,定期监测血清中的中和抗体(a)和直肠温度变化(b)(n = 6)。使用GraphPad Prism软件进行分析(***p值<0.001)。
此外,在攻毒106.6TCID50的PRV-HNLH后,所有被攻毒的猪的直肠温度上升了4天,然后开始下降。不同组的免疫猪的发热情况见图2b。用PBS、gB和灭活苗免疫的仔猪的直肠温度(40.7-42.1℃)都超过了40.5℃,而gD和gB+D组的仔猪的直肠温度则没有升高(39.5-40.3 C)。为了检测排毒情况,从口咽液(OPF)样本中提取病毒DNA,用PRV-gE特异性引物进行扩增。攻毒后,第1天至14天, gD或gB+D免疫的猪没检测到排毒,而PBS组的仔猪在第4天至8天检测到排毒,gB组第4天到第6天检测到排毒。在灭活苗组中,猪从第5天到第7天均检测到排毒(表1)。最后,在对照组中,任何时候均未检测到排毒。
对于gE抗体,用gD或gB+D免疫的猪的血清,第14天前都是阴性的;用PBS免疫的猪的所有血清样本从第10天到第14天均为阳性;在gB免疫组中,一头仔猪在第10天时转为阳性;在灭活苗组中,两头猪第10天时为阳性,并有一头猪第12和14天时为阳性。在整个过程中,对照组的猪血清均为阴性(表2)。
3.4. 病毒在组织中的复制和免疫组化
为了分析不同组织的感染水平,每组随机选择3头仔猪,在第10天安乐死,收集大脑、小脑、扁桃体和肺部,每个器官的一部分于-80摄氏度保存,用于荧光定量PCR分析,确定PRV的病毒载量;每个组织的另一部分在4%(w/v)多聚甲醛中固定,用于免疫组化和组织病理学检查。结果显示,用gD、gB+D和灭活苗免疫的猪的组织中几乎检测不到病毒DNA,而PBS组的大脑(8×102 Copies/mg)和肺部(4×102 Copies/mg)检测到病毒(图3a)。由于检测量的限制(102Copies/mg),在小脑和扁桃体中没有检测到病毒。免疫组化检查显示,gD组(图3b中)和gB+D组(图3b右)的组织几乎没有被感染的细胞,说明受病毒感染损伤非常小。相比之下,在PBS组,几乎所有的细胞都被感染了(图3b左)。总的来说,gD和gB+D组的受感染的细胞百分比最小,其次为灭活苗组和gB组的肺部和大脑(补充图4)。
为了准确评估保护作用,对感染率进行了分析。经过统计分析,与PBS组(90.3%和78.9%)、gB组(42.3%和30.3%)和灭活苗组(45.7%和16.7%)相比,gD组(10.6%和6.8%)和gB+D组(9.8%和5.8%)的大脑和肺部的感染率明显下降(图3c)。
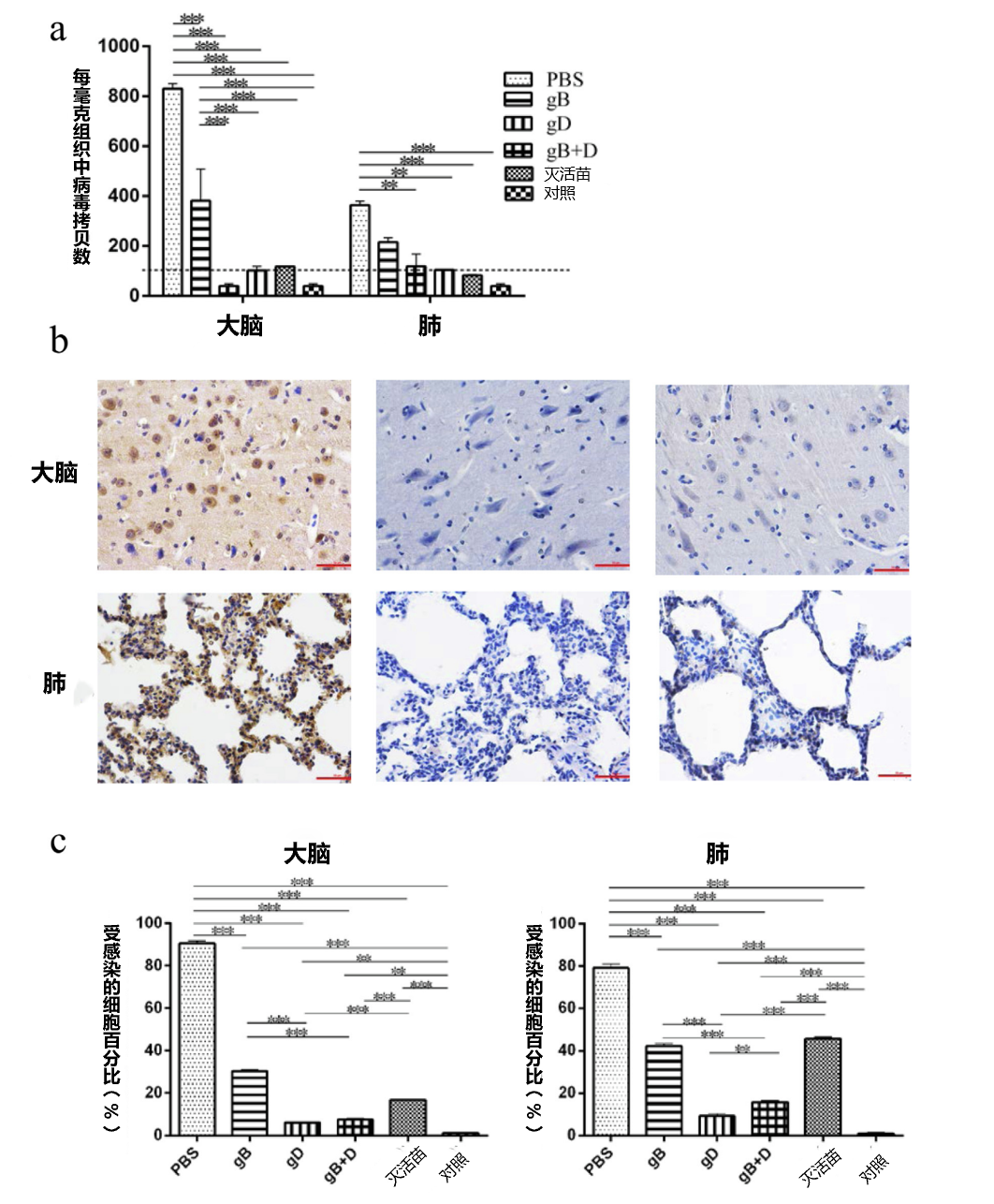
图3. 猪组织中PRV基因组的定量和免疫组化。用UL54引物对猪组织中的PRV DNA进行荧光定量PCR。。PRV载量(a)显示为每毫克组织的拷贝数。用PBS(左)、gD(中)和gBD(右)免疫的猪的肺部和大脑(b)进行了免疫组化检查(比例:100 um)。感染率对用PBS、gB、gD、gB+D和灭活苗免疫的猪的大脑和肺部感染细胞的百分比(c)进行了统计分析(n = 3)。使用GraphPad Prism软件对数据进行分析(**p< 0.01,***p< 0.001)。
3.5. 免疫猪和攻毒猪的代表性器官的组织病理学分析
每组中抽取3头猪的组织(大脑、小脑、肺和扁桃体)样品,经苏木精-伊红(H&E)染色后进行组织病理学检查,分析PRV-HNLH攻毒后的组织损伤程度。gD(图4b、e、h和k)和gB+D组(图4c、f、i和l)猪的组织没有明显的病理损伤。PBS组,大脑中的血管扩张和充血(图4a)。此外,在PBS组的小脑中观察到无序的浦肯野氏细胞和血管周围的袖套现象(图4d),肺部充血(图4g),扁桃体坏死(图4j)。与gD组和gB+D组相比,灭活苗组和gB组(补充图5)的病理损伤更为严重,但灭活苗组和gB组对病毒损伤的保护作用优于PBS组。
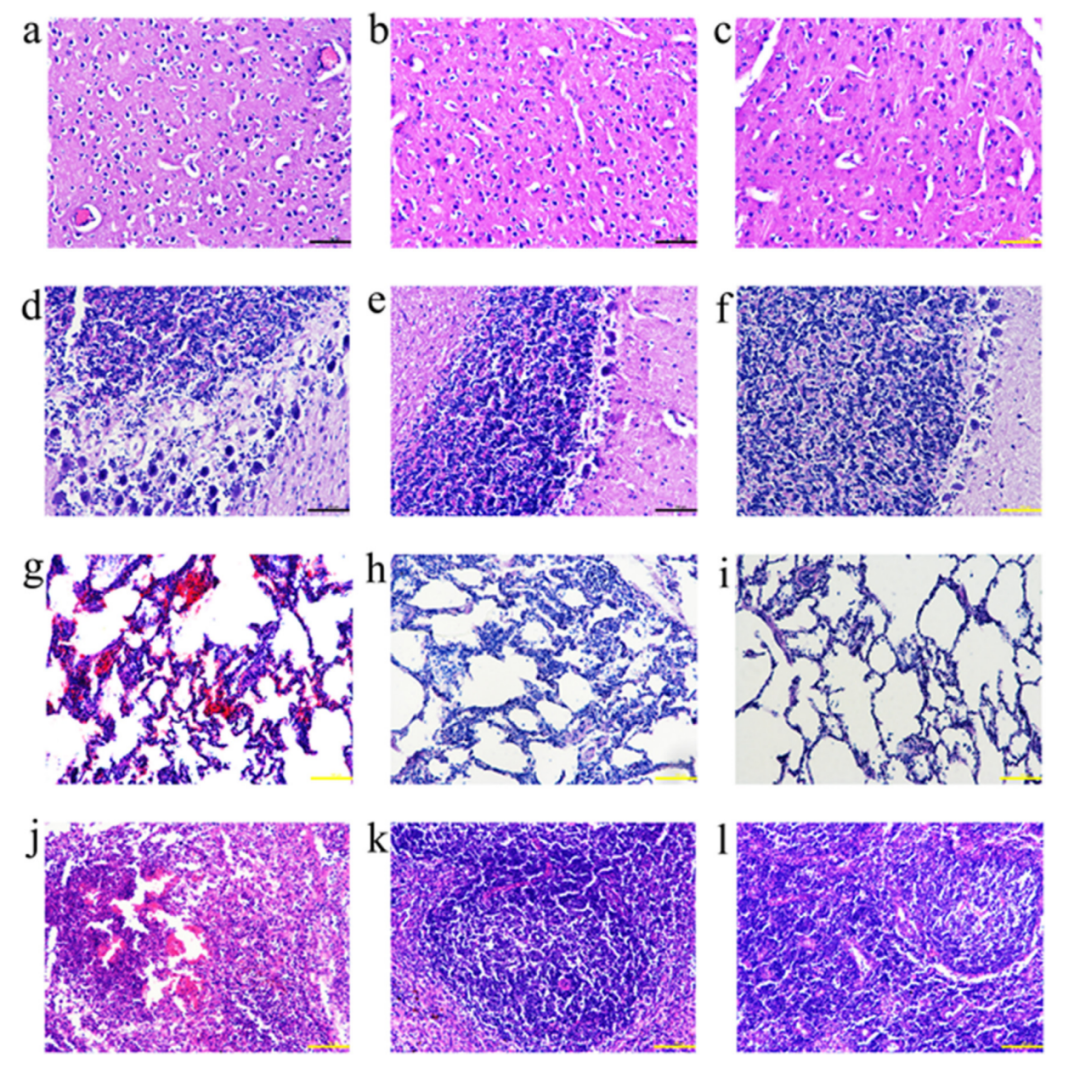
图4.疫苗免疫的猪和攻毒后的猪的代表性器官的组织病理学。PBS(a)、gD组(b)和gB+D组(c)的脑组织,PBS(d)、gD组(e)和gB+D组(f)的小脑组织。PBS(d),gD组(e)和gB + D组(f),PBS(g),gD组(h)和gB + D组(i)的肺组织,以及PBS(j),gD组(k)和gB + D组(l)的扁桃体组织。在10个月大时采集扁桃体组织,切成3-4 um的片状,用H&E染色,在20×放大镜下分析。比例:100 um
3.6. 免疫反应和PRV特异性中和抗体的持续时间
为了评估免疫效果,从血清中分离淋巴细胞,进行T淋巴细胞增殖试验。结果显示,在攻毒前后,gB和gB+D免疫的猪的淋巴细胞的产生比PBS组多(图5a)。为了评估T细胞的反应,我们评估了攻毒前7天和攻毒后4天血清中的IFN-γ水平。gB和gB+D疫苗的猪的IFN-γ水平明显高于PBS和gD组(图5b)。
为了检测PRV特异性中和抗体的持续时间,分别给猪(n = 4)注射了25 ug gB或gD,并检测血清中的中和抗体,gD免疫的猪的中和抗体一直持续至16周,用gB免疫的猪的血清中没有检测到中和抗体(图5c)。为确保实验不受野毒PRV感染的影响,从研究开始到结束,对gE抗体进行了检测,所有血清样本均为阴性(补充图6)。
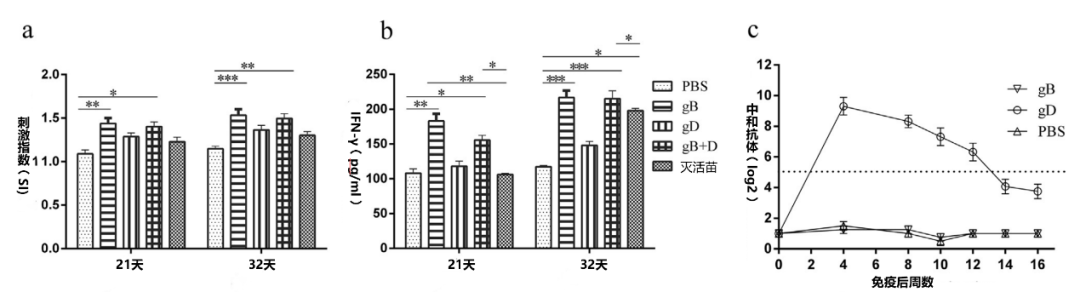
图5. 免疫前后和PRV特异性中和抗体持续时间。T淋巴细胞增殖(a)是在淋巴细胞上清液中进行的,这些淋巴细胞是由PRV攻毒前7天或攻毒后4天从血样中分离出来的,检测了攻毒前7天和攻毒后4天血清中的IFN-γ(b)水平。中和抗体持续时间(c)是在单次免疫后测定的(n = 4)。使用GraphPad Prism软件进行分析(*p< 0.05, **p< 0.01, ***p< 0.001)。
4讨论
PRV在全世界的猪场流行了近100年,给一些国家的养猪业带来了相当大的经济损失。以前的研究表明,PRV非净化猪场相比PRV净化猪场每年多损失802万元人民币。最近在中国报道的人类感染PRV,表明PRV可能对公共卫生构成重大威胁。因此,净化PRV不仅可以带来经济效益,而且对公共卫生和安全也很重要。
自2011年底以来,尽管免疫了Barthak-61疫苗,但PRV的变异株开始出现。研究表明,新毒株可能是由疫苗和野生毒株之间的基因重组造成的,这大大加强了病毒的毒力。因此,我们迫切的需要一种新型、安全并且有效的疫苗。在本研究中,我们获得了高纯度的gB、gC和gD抗原,评估了其对小鼠和猪的保护效力。
为了引起强大的免疫反应,抗原的糖基化是必须的,尤其是对于糖蛋白。因此,我们用Bac-to-Bac杆状病毒系统中表达了这三种糖蛋白,以便蛋白翻译后可以进行更好的修饰。本研究中表达的gB、gC和gD的分子质量预期分别为78.1kDa、45.8kDa和38.4kDa,但表达后的分子质量分别为100kDa(补充图1d)、63kDa(补充图1e)和48kDa(补充图1f),说明这些成熟的蛋白发生了翻译后的修饰。
在最初的动物实验中,我们参考了以前的研究,共用100 ug gD(gp50)免疫猪。为了刺激更好的免疫效果,我们对小鼠免疫了总共30 ug的蛋白,然而,基于免疫评估的结果,重组蛋白gB和gD表现出较高的免疫原性;因此,我们减少了免疫剂量,在仔猪上使用了25 ug。一般来说,在野毒攻毒后,动物的中和抗体的水平会迅速增加。然而,如图1b所示,中和抗体首先下降,然后在用蛋白免疫的组中增加。攻毒之前,抗原免疫诱导的高滴度中和抗体可能被野毒攻毒引起的中和抗体上升所掩盖或延迟。如图1所示,我们发现灭活苗组的中和抗体迅速上升。相反,小鼠在攻毒前没有产生任何的中和抗体。为了研究gB、gC和gD的免疫协同作用,用这三种蛋白的抗原混合物对小鼠进行免疫,gB+D组的中和抗体滴度明显高于gB+C和gB+D组,这种情况从第35天持续到第70天(补充图2a)。gB+D组小鼠的存活率(100%)高于gB + C组(75%)和gC + D组(62.5%)(补充图2b),表明gB和gD对小鼠PRV感染提供了更有效的免疫保护。此外,用gB和gD免疫的小鼠的存活率明显高于gC,这意味着gB和gD是更有效的亚单位候选疫苗,这三种蛋白之间没有明显的免疫协同作用。因此,我们进一步评估了gB和gD对猪的免疫效应。
用gD和gB+D免疫的猪检测到高滴度的中和抗体,而gB免疫的猪没有诱导中和抗体,这意味着中和抗体主要由gD而不是gB诱导产生。攻毒后,用gD单独免疫和gB+D联合免疫的猪没有出现发烧现象,而PBS组的直肠温度从第1天到第6天均超过40.5℃;因此说明,gD可以提供更好的保护。经免疫组化显示,与PBS组的感染率相比,gD和gB+D组在肺部的感染率降低了88.2%和82.6%,在大脑的感染率降低了91.2%和90.7%,而gB和灭活苗组在肺部的感染率降低了53.2%和49.4%,在大脑中的感染率降低了61.6%和78.8%(图3c);这与荧光定量PCR的结果一致。gD组的仔猪用25 ug gD免疫,而gB+D组的仔猪则用12.5 ug gB和12.5 ug gD免疫。数据显示,gB不能诱导猪的中和抗体,而gB+D组的肺部感染细胞百分比明显高于gD组,这就确定了gD可以对猪进行有效的保护。另外,如图3所示,gB+D组和gD组的大脑和肺部的PRV拷贝数都接近检测阈,差异没有统计学意义。gB+D组肺部感染细胞的百分比明显高于gD组,这表明gD组表现更好。上述数据表明,gB不能诱导猪的中和抗体,所以我们选择了gD,并测定了抗体持续时间。组织病理学分析表明,gD组和gB+D组的组织几乎没有出现组织病理学变化,说明gD可以保护器官免受病毒损害。
尽管一些研究表明,在小鼠中gB可以诱导PRV针对性的保护性抗体,但在猪中是否能达到同样的免疫效果仍是未知数。在本研究中,结果显示,gB在仔猪中没有诱导出中和抗体。然而,荧光定量PCR和免疫组化及组织病理学分析显示,gB组的病毒载量也有所下降,这表明gB可能诱导细胞免疫。进一步分析淋巴细胞增殖和IFN-γ水平显示,gB组的淋巴细胞刺激指数和IFN-γ水平明显更高,这意味着gB组的T细胞的免疫反应比其他组更有效地呈现出来(图5c)。
以前的研究表明,用编码PRV-gD的质粒进行免疫,可以诱导出中和抗体,并且在攻毒后表现出较少的临床症状。然而,质粒在不同器官和动物中的表达量是无法控制的。此外,基因重组的风险仍然存在。另外,由痘苗病毒表达的gD或从PRV颗粒中获得的gD被证明可以保护猪免受PRV的致命感染,然而,这种技术费时、不经济且复杂。在本研究中,我们以更经济、更方便的方式获得了纯度超过98%的gD,鉴定了更多不同的指标,包括中和抗体、病毒量、病理切片和免疫组化。此外,在以前的研究中,中和抗体的持续时间并不明确。我们证明,有效的中和抗体滴度在25以上可维持到12周,这表明gD可以提供长期、持续和有效的保护(图5d)。
总之,本研究获得的gD可以诱导有效的中和抗体并明显降低小鼠和猪的感染率。此外,gD可以减少不同组织中的病毒量和病理病变,这表明gD可以作为控制PRV的主要候选疫苗。