
由于消毒剂灭活病毒机制不同,本研究拟采用荧光定量 PCR 方法检测戊二醛、酚、含氯等 7 类 9 种常用消毒剂与 ASFV 培养物作用后的产物,评估对检测结果的影响,以期为 ASF 防控实践中科学、客观评价分析消毒效果提供技术参考。
1 材料与方法
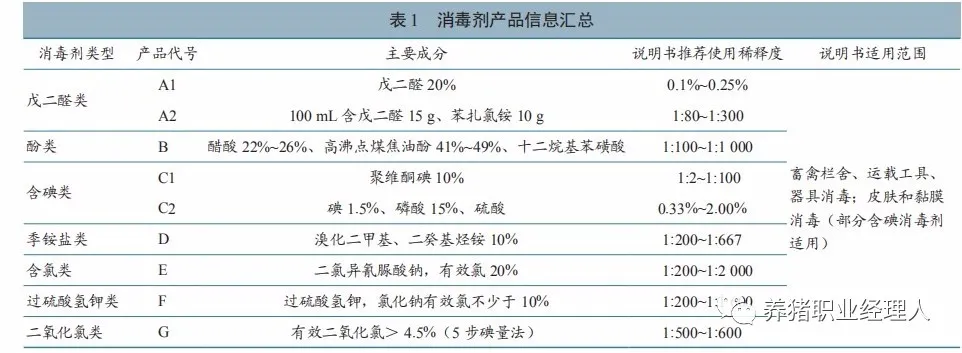
1.1 消毒剂
收集市面常见的戊二醛、酚、含碘、季铵盐、含氯、过硫酸氢钾、二氧化氯等 7 类消毒剂,包括戊二醛类2 种、酚类1 种,含碘类2 种、季铵盐1 种、含氯类 1 种、过硫酸氢钾类 1 种、二氧化氯类 1 种。消毒剂产品详细信息见表 1,所有产品均注册有兽药产品批准文号,试验时均在有效期内。
1.2 病毒
ASFV 中国分离株:CN2018/1,由国家非洲猪瘟参考实验室分离鉴定并保存。
1.3试剂与耗材
DMEM 培养基、胎牛血清,购自 GIBCO 公司;细胞瓶及 96 孔细胞板,购自 Corning 公司;病毒RNA/DNA 提取试剂盒,购自天根公司;荧光定量PCR 扩增试剂 Luna 通用探针法 qPCR 预混液,购自 NEB 公司。
1.4 猪肺泡巨噬细胞、红细胞和血清制备
无菌采集健康猪肺脏,向肺脏注入灭菌 PBS 灌洗数次,收集灌洗液;离心收集猪肺泡巨噬细胞, 按 5×106 个 /mL、100 μL/ 孔接种 96 孔板;铺板次日进行测试。
同步无菌采集抗凝血,离心收集血清;之后将细胞沉淀洗涤 3~5 次,弃去白细胞和血小板,用PBS 配成 10% 猪红细胞悬液,4 ℃保存备用。
1.5 病毒滴度测定
采用含 1% 猪血清的 PBS 10 倍连续稀释ASFV 培养物至 10-8,以每孔 100 μL 接种 96 孔板上的猪肺泡巨噬细胞培养物,同时加入 1% 猪红细胞 10 μL,每个稀释度做 4 个重复孔。将 96 孔板置于 37 ℃ 5% CO2 条件下培养 6 d,每天观察,记录并统计各稀释度培养孔中红细胞吸附(HAD) 反应结果,采用 Reed-Muench 法计算半数红细胞吸附量(HAD50)。
1.6 消毒剂与 ASFV 作用
采用 PBS 10 倍连续稀释经病毒滴度测定后的ASFV 培养物,取 101~104 倍稀释液备用。参考农业农村部文件《关于在非洲猪瘟防控中做好消毒剂选择工作的通知》, 以有效灭活 ASFV 为目的,基于畜禽栏舍、运载工具、器具消毒及皮肤黏膜(部分含碘类消毒剂适用) 等不同消毒场景,按消毒剂说明书标明浓度范围合理选择工作浓度,并将消毒剂原液制成 10 倍工作浓度备用。将 0.1 mL 消毒剂 10 倍工作浓度液和0.1 mL 不同稀释度病毒液分别加入到 0.8 mL PBS 中充分混合,20 ℃条件下作用 30 min,作用后产物直接用于后续测试。无法制成 10 倍工作浓度液的含碘类消毒剂 C1,按照 1:2 工作浓度,将 0.5 mL 消毒剂原液和 0.1 mL 不同稀释度病毒液,分别加入到 0.4 mL PBS 中充分混合,按相同条件作用处理,作用后产物直接用于后续测试。阳性对照组, 直接将 0.1 mL 不同稀释度病毒液加入 0.9 mL PBS 中充分混合;阴性对照组,直接取 1 mL PBS。阴、阳性对照均按相同条件作用处理,作用后产物直接用于后续测试。
1..7 病毒 DNA 提取
取 200 μL 上述作用后产物,按病毒 RNA/ DNA 提取试剂盒说明,于 Thermo 自动核酸提取仪上提取病毒核酸,将提取的核酸保存于 -80 ℃冰箱备用。
1.8 荧光定量 PCR 扩增
采用 OIE《陆生动物诊断实验和疫苗手册》(2012 版)第 2.8.2 章节中,King 等 [1] 基于 VP72蛋白建立的 ASFV 荧光定量 PCR 方法检测。上、下游引物和探针由上海生工生物技术有限公司合成。PCR 反应体系为:2×qPCR 预混液 10 µL,上、下游引物(10 μmol/L)各 0.8 µL,探针(10 μmol/L)0.4 µL,模板 DNA 2 μL,最后用灭菌水补齐至20 μL。反应条件为:50 ℃孵育 2 min;95 ℃预变性 3 min;95 ℃预变性 15 s,58 ℃退火延伸 1 min(采集 FAM 荧光信号),共 40 个循环。
1.9 检测结果分析
按 1.6—1.8 步骤,重复处理各组样品 3 次并检测,统计平均 Ct 值,计算批间变异系数;取同一批次提取核酸重复检测 3 次,统计平均 Ct 值, 计算批内变异系数。统计各组检测平均 Ct 值,将各组检测结果分别与对应阳性对照组比较,采用SPSS 21.0 软件进行单因素方差分析,以 P < 0.05 为差异有统计学意义。
2 结果
2.1 病毒滴度测定
经 测 定,ASFV 培 养 物 病 毒 滴 度 为 107.2 HAD50/mL。采用 PBS 10 倍连续稀释后,本试验中与消毒剂作用的 ASFV 滴度为 102.2~105.2 HAD50/mL。
2.2 各消毒剂检测结果
消毒剂在选定稀释度下与不同滴度 ASFV 作用后,采用荧光定量 PCR 检测,结果详见表 2。重复处理样品检测 3 次,各组平均 Ct 值批间变异系数为 0.3%~6.7%;取同一批次样品提取病毒核酸重复检测 3 次,各组平均 Ct 值批内变异系数为0.1%~2.3%。
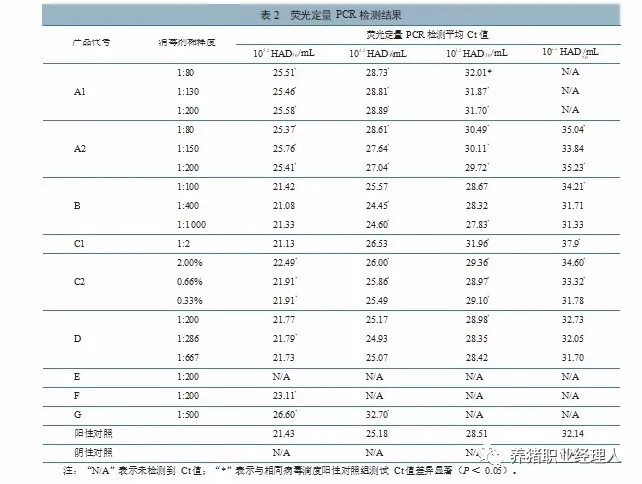
结果(表 2)显示,本研究中不同滴度 ASFV 与戊二醛类消毒剂作用后,荧光定量 PCR 检测 Ct 值均显著上升。与阳性对照组相比,戊二醛类 A1 产品 1:80~1:200 稀释下,当病毒滴度为 105.2~103.2 HAD50/mL 时,检测 Ct 值上升约 3.19~4.15;当病毒滴度为 102.2 HAD /mL 时,未检测到 Ct 值。A2 产品在 1:80~1:200 稀释灭活不同滴度病毒后,检测 Ct 值上升 1.21~4.33。

酚类B 产品与不同滴度病毒作用后检测发现, 与对应阳性对照组测定 Ct 值基本相当,仅个别检测结果出现 Ct 值波动(如 1:200 工作浓度下灭活102.2 HAD /mL 病毒时),总体看酚类 B 产品灭活病毒后对荧光定量 PCR 检测结果影响不大。
含碘类C1 产品,当灭活病毒滴度为 105.2~104.2 HAD50/mL 时,检测 Ct 值变化不显著;当灭活病毒滴度为 103.2~102.2 HAD /mL 时,检测 Ct 值显著上升 3.45~5.76。C2 产品与不同滴度病毒作用后检测发现,当灭活病毒滴度为103.2~105.2 HAD /mL 时, 比对应阳性对照组测定Ct 值稍有上升(0.46~1.06);仅灭活病毒滴度为 102.2 HAD /mL 时,2.00% 稀释度下检测结果 Ct 值明显上升(约 2.46)。
季铵盐类 D 产品与不同滴度病毒作用后检测发现,与对应阳性对照组测定 Ct 值基本相当,基本无显著差异。
含氯类 E 产品与不同滴度病毒作用后检测, 均未检测到 Ct 值。
过硫酸氢钾类 F 产品,当灭活病毒滴度为105.2 HAD /mL 时,检测 Ct 值上升约 1.68;当灭活病毒浓度为 104.2~102.2 HAD /mL 时,均未检测到 Ct 值。
二氧化氯类 G 产 品,当灭活病毒滴度为 105.2~104.2 HAD /mL 时 , 检 测 Ct 值 上 升5.17~7.52;当灭活病毒滴度为 103.2~102.2 HAD /mL时,均未检测到 Ct 值。
3 讨论
ASFV 属于囊膜 DNA 病毒,对环境抵抗力强, 但对戊二醛、含氯、含碘类等多数常用种类消毒剂敏感 [2]。现场消毒后,常需对消毒效果进行监测评价,以防止由于消毒不彻底造成 ASFV 传播扩散。目前,采用病毒分离方法只能在农业农村部指定实验室中开展,且技术难度大、检测周期长,而检测抗原的 ELISA 或胶体金等免疫学检测方法敏感性达不到消毒效果评价要求。分子生物学方法特别是荧光定量 PCR 方法,具有简便、快速、高通量等优势,是实践中 ASFV 病原检测最主要手段,且适用于唾液、血液、组织、环境拭子等多种样品类型,可广泛应用于养殖场、屠宰场、无害化处理厂、运输车辆等多种场景消毒效果评估。
结果显示,与其他几种消毒剂相比,含氯类(二氯异氰尿酸钠)、过硫酸氢钾类、二氧化氯类 3 类消毒剂,消毒后对荧光定量 PCR 检测结果影响最显著,检测 Ct 值明显上升或未检测到,且其影响能力排序为:含氯类(二氯异氰尿酸钠)> 过硫酸氢钾类>二氧化氯类。含氯类消毒剂(二氯异氰脲酸钠)遇水后可释放出次氯酸,可导致病原蛋白质变性、改变膜通透性并可直接影响 DNA 合成等来杀灭病原 [3]。本研究中含氧类消毒剂与滴度≤ 105.2 HAD /mL 病毒作用后检测,均未见 Ct 值。当前市售过硫酸氢钾类消毒剂,多由过硫酸氢钾、表面活性剂、无机盐与有机酸等组成,其消毒原理:一是利用过硫酸氢根的强氧化能力,在水溶液中产生羟基自由基等改变微生物细胞膜的通透性使之破裂;二是使用时过氧离子能将氯离子氧化为次氯酸,达到杀灭病原目的 [4]。本研究中过硫酸氢钾类消毒剂与滴度为 105.2 HAD /mL 病毒作用后检测时 Ct 值上升,与≤ 104.2 HAD /mL 病毒作用后检测未见 Ct 值。二氧化氯类消毒剂是一类强氧化剂,并兼具含氯类消毒剂作用机制,可与细胞内部酶发生氧化反应,还可氧化分解氨基酸、核酸等,使微生物蛋白质的合成被抑制并导致蛋白质功能丧失 [5]。本研究中当二氧化氯类消毒剂与滴度104.2~105.2 HAD /mL 病毒作用后检测 Ct 值上升, 与≤ 103.2 HAD /mL 病毒作用后检测均未见Ct 值, 可推断其核酸降解能力弱于前两者。
戊二醛类消毒剂,主要通过凝固病原微生物蛋白质中的氨基、羧基,破坏病原微生物蛋白分子使其死亡 [6],在本研究中戊二醛类消毒剂显示较弱的核酸降解能力。A1 产品仅当与滴度≤ 102.2 HAD50/mL 病毒作用后检测未见Ct 值。A1、A2 相比, 当灭活病毒滴度为 102.2 HAD /mL 时,A2 仍可检测到 Ct 值而 A1 未检测到,表明 A1 对检测 Ct 值影响大于 A2,推测可能与 A1 具有更高戊二醛工作浓度有关。
含碘类消毒剂消毒时,游离状态的碘原子产生强氧化作用,主要破坏病原体的细胞膜结构及蛋白质分子,并可部分作用于核酸 。本研究中显示含碘类消毒剂具有较弱的核酸降解能力,C1 仅当与滴度为 103.2~102.2 HAD /mL 病毒作用后,检测Ct 值出现上升。
本研究中的酚类和季铵盐类消毒剂,消毒后与对应阳性对照组测定 Ct 值基本相当。酚类属于原生质毒物,可穿透破坏细胞膜、沉淀蛋白质 [2];季铵化合物是一种膜活性剂,可损伤、破坏细胞膜, 导致细胞质电位和 pH 梯度变化 [2],两者在消毒原理上对核酸作用小。
采用荧光定量 PCR 检测评估对 ASFV 的消毒效果时,未检测到 Ct 值的原因:一方面是消毒剂本身即具有核酸降解能力,另一方面是消毒前后进行的清洁、清洗也会清除 ASFV 核酸。由于荧光PCR 方法原理是对病毒核酸检测,现场检测时若结果阳性,仅表示存在 ASFV 核酸,并不能说明病毒本身是否存活,是否达到有效灭活效果还应根据现场条件以及使用消毒剂种类、使用浓度、作用时间等因素综合分析。此外,也可考虑采用指示微生物方式进行辅助的消毒效果验证。综上所述,本研究评估了 7 类 常用消毒剂灭活 ASFV 后,对荧光定量 PCR 检测结果的影响,可为 ASFV 消毒效果评价提供技术参考。
最新发布