由于荧光定量PCR(Q-PCR)具有极高的灵敏性,极容易受到污染,所以其对实验室的配置和操作人员的要求更为苛刻。现将Q-PCR在非洲猪瘟检测过程中遇到的常见问题与解决方案和大家分享如下。
1 Q-PCR的CT值显示异常
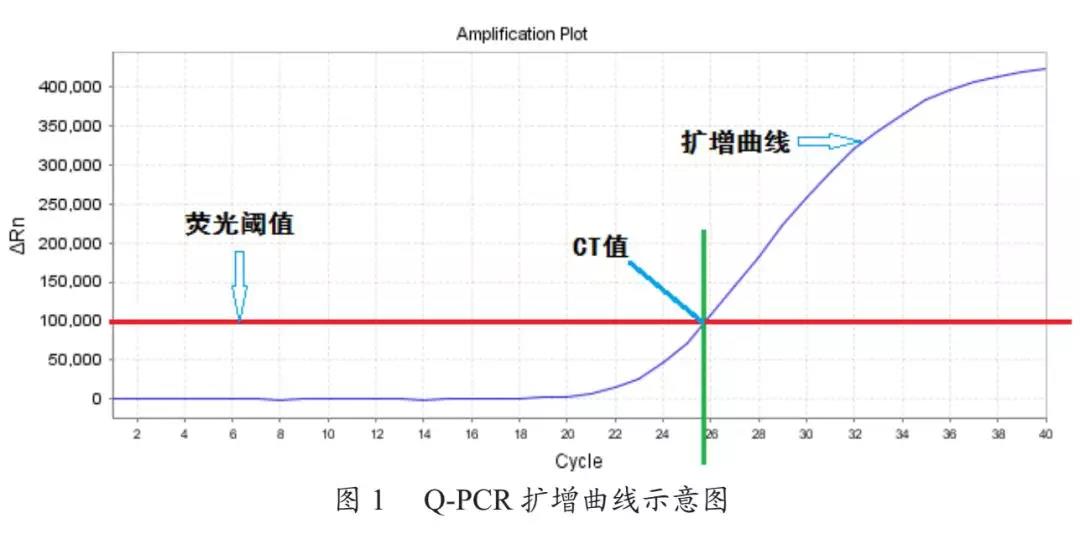
Q-PCR是利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,通过CT值和标准曲线的关系对起始模板进行定量分析。扩增曲线反应了Q-PCR动态进程的曲线;荧光阈值是以前15个循环信号作为荧光本底信号(baseline),一般荧光阈值的默认设置是3~15个循环的荧光信号的标准偏差的10倍;CT值是PCR扩增过程中,扩增产物的荧光信号达到设定的阈值时所经过的扩增循环次数,见图1。
1.1 阳性对照或阳性样品不显示CT值及解决方案
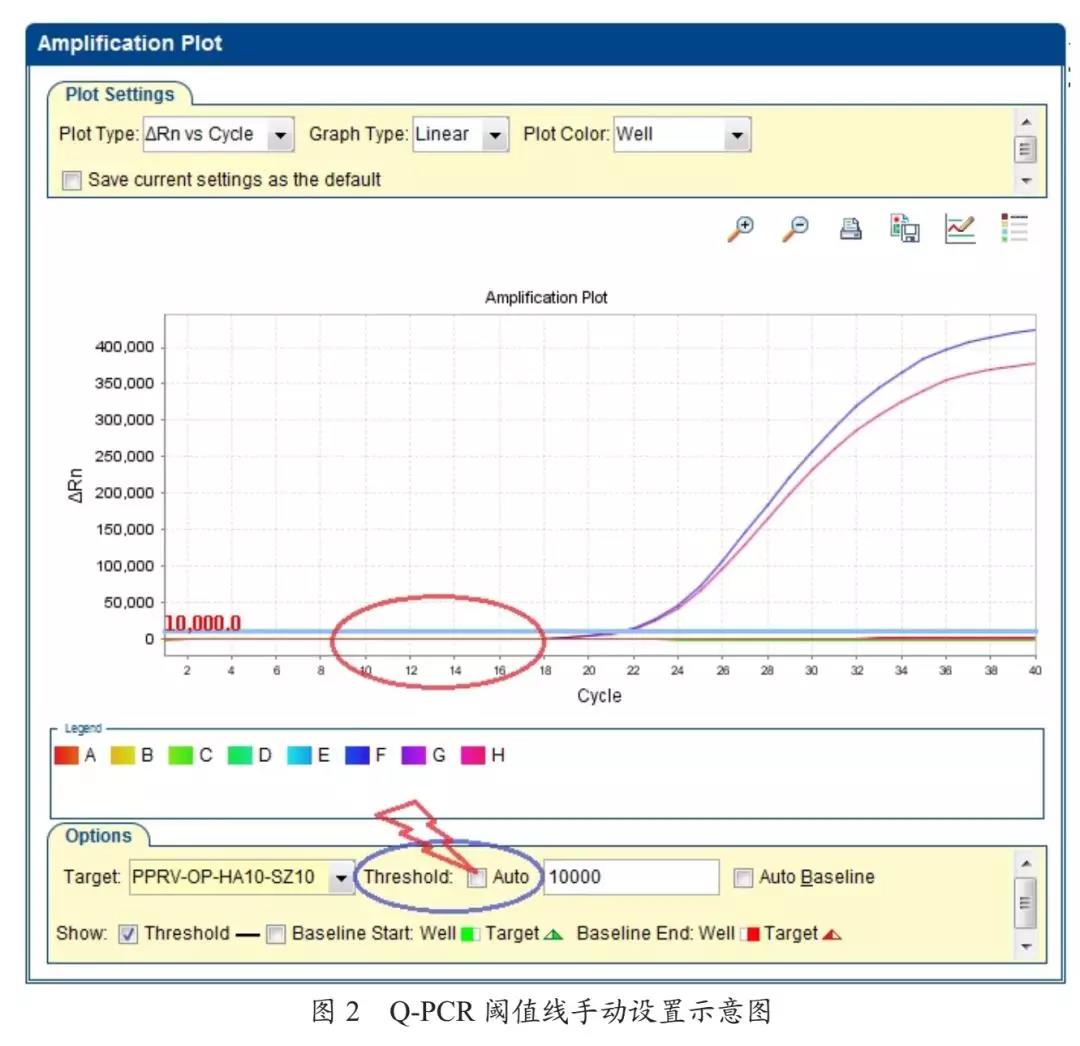
部分检测机构的实验室人员在进行非洲猪瘟样品检测时,时常出现阳性对照有典型的“S”型扩增曲线,但不显示CT值(CT值显示为Undeter)的情况,出现这种情况的主要原因是仪器默认的荧光阈值线过高。
解决方案。把Threshold的Auto自动取消,设成手动,荧光阈值一般设在PCR指数扩增的起始,并高于阴性对照曲线。其数值选择与试剂盒的性能有关,对荧光强度较高的扩增曲线,阈值的设定不一定非要遵循固定的原则。因此,针对试剂盒性能不同,实验室应建立自己的阈值范围,尽可能保证低值样本检测结果的稳定性,见图2。
1.2 检测样品无典型“S”形扩增曲线,但其CT值显示为阳性及解决方案
被检样品无典型“S”形扩增曲线,但其CT值显示为阳性(按照试剂盒说明书CT值判定标准)的情况在实际检测过程中出现的频率更高,出现这种情况的主要原因大多是由于被检样品不够新鲜或经反复冻融等。
解决方案。经过对部分实验室的实地调研发现,出现上述情况的实验室在检测试剂盒提供的阴性对照或无菌无核酸酶水时,则没有出现“无典型扩增曲线,但CT值显示为阳性”的情况,这就说明出现这种情况的主要原因大多是由于被检样品不够新鲜或经反复冻融等,因此被检样品要尽量新鲜,4~8℃保存的血清或抗凝血样品一般不超过120h,唾液样品经离心后再进行检测,冻融次数一般不超过3次。
2 实验过程操作不够规范
通过实地调研发现不少检测机构的实验人员在进行荧光PCR检测时,操作很不规范,对于检测试剂盒的说明书,只知其然而不知其所以然,在遇到问题时也不知该如何解决。
2.1 加样不规范
1)加入样品模板及阳性对照前,未进行瞬时离心,致使开盖时,由于盖上粘有液体而引起气溶胶污染;
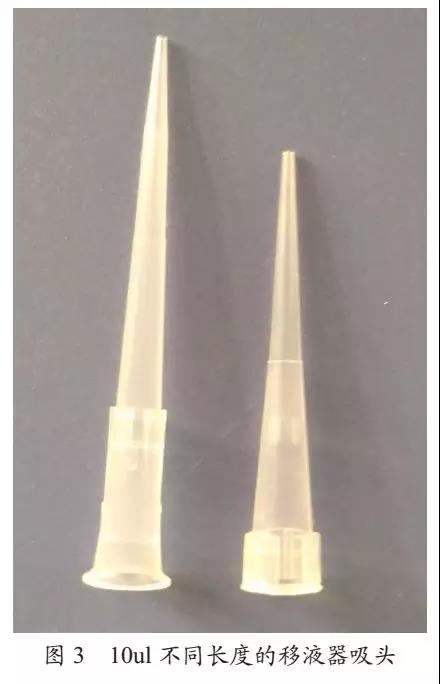
2)进行加样时使用的移液器吸头较短,因移液器的污染而导致样品间的交叉污染,图3;
4)加入核酸模板后未尽快上机,致使探针淬灭。
2.2 扩增后处理不规范
1)扩增后,在实验区域内开启PCR反应管,导致试验区域的气溶胶污染;
2)检测过程中用到的吸头、离心管及PCR反应管未及时进行清理和高压处理。
2.3 解决方案
1)在打开装有PCR试剂的反应管、阳性对照及样品核酸模板前应先瞬时离心,将管壁及管盖上的液体甩至管底;谨慎开启反应管,防止管内液体溅出或形成气溶胶导致污染;
2)对于荧光PCR检测,八字原则必须遵守:避光、低温、快速、盖紧;即避免强光直接照射反应管,在冰盒上配制反应体系,加入核酸模板后应尽快上机,上机前检查反应管是否盖紧,以免荧光物质泄漏污染仪器;
3)检测过程中用过的吸头请直接丢入装有1%次氯酸钠的废物缸内,与其他废弃物品一同灭菌后丢弃,在检测结束后用核酸去除剂喷洒实验室台面(图4)。