2011年以后,从北到南,我国多数养猪地区的许多原本伪狂犬病(Pseudorabies, PR)阴性的猪场逐渐转阳。随后有研究表明,本次流行的伪狂犬病毒(Pseudorabies virus, PRV)毒株相对经典毒株(SC株)而言,多个基因有较大的差异,毒力也更强,且现有的商品化疫苗对其感染的保护力相对更差(通过羊的免疫攻毒试验)。
中和抗体作为评估疫苗免疫保护水平的一个重要指标,引起了一些养猪企业和科研院所的研究兴趣,他们对不同品牌的PRV疫苗免疫后诱导猪体产生新流行毒株中和抗体的水平及特点展开了一系列的研究。
本文将简要介绍三个有代表性的该类研究成果,以增进大家对目前不同品牌PRV疫苗对流行毒株感染保护情况及近年来PR流行特点的了解,希望能给各位养猪同仁在疫苗选择及不同感染类型猪场综合防控方面提供一些借鉴。
1 不同品牌的PRV疫苗免疫诱导流行毒株中和抗体水平的系列研究
PRV为伪狂犬病的致病病原,猪是其唯一的自然宿主,可以导致猪只发生潜伏感染、亚临床感染以及致死性感染,临床的表现和感染的毒株、感染年龄、感染的途径、感染量以及免疫保护水平等多因素有关。
长时间以来,免疫作为控制PR的有效方式被业内人士充分认可,它能够提高猪只的感染阈值、减少临床问题的发生、缩短攻毒后排毒时间和减少排毒量并能减少攻毒后潜伏感染猪的排毒等,但是,免疫往往不能完全阻止PRV的感染。
在减少感染方面,细胞免疫起着重要作用,但要阻止感染,往往需要良好的细胞免疫和体液免疫(中和抗体)协同作用。无论是阻止猪只感染,还是感染后减少临床问题以及缩短排毒时间和减少排毒量,中和抗体都起着非常重要的作用。
但是,近年来随着PRV新流行毒株在全国范围内的流行,有研究机构认为,目前使用的Bartha-K61株疫苗免疫诱导的针对流行毒株的中和抗体水平相对以前的经典毒株更差了,一些养猪企业和科研院所为了更清楚地了解目前不同品牌Bartha-K61株疫苗诱导产生新流行毒株中和抗体水平的差异和特点进行了一些研究。
1.1 不同品牌的PRV疫苗免疫诱导流行毒株中和抗体水平差异性的研究
2014年,广东源丰农业有限公司选择了4种著名的、不同品牌的PRV疫苗,分母猪和生长猪2个不同群体进行了试验。
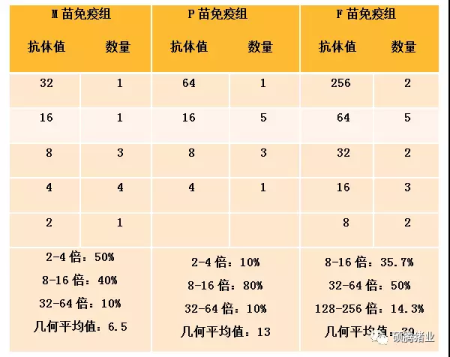
母猪试验:该场共有约5000头基础母猪,分多条生产线饲养。选择其中一条约1000头的生产线免疫P苗(硕腾公司“扑伪佳”,疫苗株为Bucharest株),另一条约1200头的生产线免疫F苗(硕腾公司“清伪灵”,疫苗株为Bartha-K61株),其余生产线全部免疫M苗(某进口品牌,疫苗株为Bartha-K61株)。在该次分组免疫之前的6个月,全场母猪免疫的都是M苗。在分组免疫后的6个月,从M、P、F三个试验组分别随机抽取10头、10头、14头母猪的血清用PRV流行毒株(HuBei株)做中和试验。在进行中和试验之前,检测了这34个样品的gE抗体,结果均为阴性。中和试验结果如表1-1,组内样品按中和抗体效价从高往低排列。
为了更直观地表示抗体水平的高低,本试验用能够中和病毒的最高血清稀释倍数来表示样品的中和抗体水平,例如,血清抗体值为“8”,则表示该血清的中和抗体效价为1︰8。
表1-1 M、P、F苗试验组母猪免疫疫苗6个月后的中和试验结果
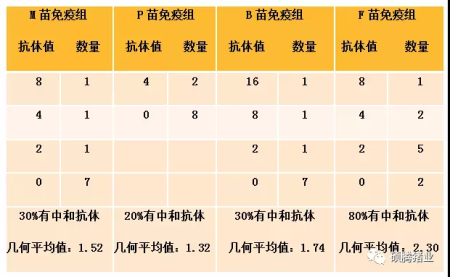
生长猪试验:生长猪免疫试验分为4组进行,每组10头猪,分别免疫M、P、B和F等不同品牌的PRV疫苗(M、P、F苗同母猪试验疫苗,B苗为另一种进口品牌的PRV疫苗,疫苗株也是Bartha-K61株)。免疫程序:11周龄首免,15周龄二免。试验猪只全部来源于同一生产线同一批次。第二次免疫5周后收集血清用PRV流行毒株(HuBei株)做血清中和试验,试验结果见表1-2。
表1-2 各试验组生长猪免疫2次疫苗后5周的中和试验结果
由表1-1、1-2可知,无论是在母猪试验还是在生长猪试验中,不同品牌的PRV疫苗免疫诱导猪只产生的流行毒中和抗体水平差异显著。在本研究中“清伪灵”免疫诱导猪体产生的流行毒中和抗体的能力明显优于其它3个著名疫苗。另外,同样的疫苗免疫母猪后诱导产生的中和抗体水平要比生长猪优秀得多,M、P、B品牌的PRV疫苗2次免疫生长猪后中和抗体阳性率都只在20~30%之间,而且中和抗体平均值不超过2倍。
一般认为中和抗体值超过2倍即可提供临床保护力,而“清伪灵”免疫2次后5周,中和抗体阳性率为80%,平均值为2.30,为4个疫苗试验组最高的。那么为什么用同样毒株生产的PRV疫苗免疫诱导的流行毒中和抗体水平相差如此之大?笔者认为可能和疫苗毒传代代次、培养细胞、抗原含量、抗原质量及佐剂等多个因素有关。
1.2 不同品牌的PRV疫苗免疫诱导的流行毒株中和抗体和gB抗体相关性的初步研究
为方便起见,我们常常通过ELISA检测gB抗体来评估疫苗免疫后的效果。一般来说,gB抗体水平越高,中和抗体水平会越高,但是,流行毒株出现,gB基因的一些位点发生变异以后,这种gB-ELISA的抗体水平和流行毒的中和抗体水平仍然具有强烈的正相关性吗?
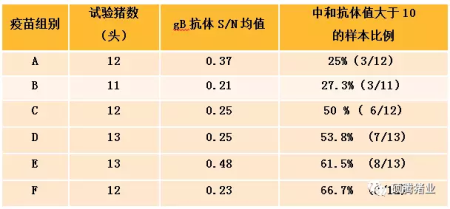
2013年4~6月,浙江省农业科学院畜牧兽医研究所在研究不同品牌疫苗诱导流行毒的中和抗体能力的同时,研究了gB抗体和流行毒(未命名毒株)中和抗体的关系。他们把来自常规商品猪场的73头10周龄gE抗体阳性(临床健康,应该是母源抗体)的仔猪分成6组(A、B、C、D、E、F),不同的试验组分别用1种不同的PRV疫苗免疫1头份,免疫后30天,检测每头试验猪的gB-ELISA抗体和流行毒的中和抗体,检测结果见表1-3。
表1-3 不同试验组免疫疫苗30天后的gB 抗体均值和中和抗体值大于10的样本比例
注:1、E组所用疫苗为硕腾公司的“清伪灵”;2、本试验所用ELISA为阻断ELISA,S/N值和gB抗体值成反比。
由表1-3可知,目前商品化疫苗诱导生长猪产生的流行毒中和抗体水平都不太高,但是差异很大,A疫苗诱导产生的中和抗体值最低,大于10的样本比例为3/12,“清伪灵”和F疫苗诱导猪只产生的中和抗体水平最好(中和抗体值大于10的样本超过60%)。另外,也可以看到,诱导gB抗体最好的B疫苗诱导的中和抗体并不好,中和抗体值大于10的样本比例才3/11。
本试验中“清伪灵”的gB-ELISA抗体并不是很好(S/N均值为0.48,但在其未发表的另一项研究中,其它条件不变,只是试验猪由本试验的gE抗体阳性猪换成使用gE抗体阴性猪,各疫苗免疫组免疫30天后检测gB-ELISA和中和抗体,结果是“清伪灵”免疫组gB抗体和中和抗体水平都最高),但其中和抗体值大于10的样本比例相对更好。这些似乎说明,gB抗体和目前流行毒的中和抗体相关性不强,单纯通过检测gB抗体水平的高低来评估疫苗免疫后的保护水平高低不合理。
1.3 母源流行毒株中和抗体衰减规律的研究
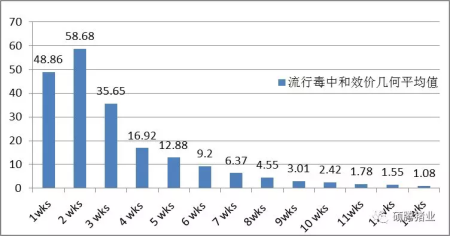
2014年7~10月,广东中山市白石猪场有限公司为了验明PRV疫苗免疫产生的母源抗体对仔猪的保护规律,进行了仔猪母源流行毒株中和抗体衰减规律的跟踪试验。他们在本场(伪狂犬病阴性场)选择了10头母猪,其中5头猪为高中和抗体水平,另5头猪为低中和抗体水平。这10头母猪的分娩时间是疫苗免疫后2个月,在此之前,母猪的免疫程序为免疫某进口品牌疫苗(Bartha-K61株),间隔4个月免疫1次。每头母猪所产仔猪各选2头,共20头,13周龄之前不予免疫,打上标记,每隔7天收集血样一次,一直到13周龄,用流行毒株(Hubei株)做血清中和试验,结果见图1-1。
图1-1 不同周龄猪只母源流行毒株(Hubei株)中和抗体的几何平均值
由图1-1可知,母猪经过多次免疫后,所产仔猪可通过初乳获得母源抗体,13周龄时仍然有针对流行毒的中和抗体,但10周龄之后抗体值即降到2倍以下。
另外,该试验验证了母源抗体的半衰期为14天,从4周龄(断奶时)到10周龄,大约每隔两周抗体衰减一半左右,规律较为明显。1~3周龄抗体衰减无明显规律,可能和奶水质量及健康状况等有关。11~13周龄抗体值低于2倍,有大部分样品属于阴性,也没表现出衰减规律。
该研究结果意味着,临床上可以通过测定断奶后、10周龄前某个时间点的中和抗体效价,按照2周半衰期的规律来推算首免日龄。首免日龄通常还需根据猪群的感染压力来确定计划免疫时能接受的中和抗体值来推算,不同的感染压力下免疫时能接受的中和抗体值有差异。感染压力小的猪群,免疫时可以设定较低的中和抗体值,反之,则需较高值。当然,确定免疫时间时还需考虑是否存在母源抗体的影响。
2 总结
由上述系列研究结果可知,目前普遍使用的PRV疫苗免疫后诱导猪体产生的流行毒株中和抗体水平差异很大,大部分疫苗免疫后不能诱导猪只产生良好的流行毒中和抗体,gB-ELISA抗体和中和抗体的相关性也不明显,“清伪灵”在诱导流行毒株的中和抗体水平上,表现相对突出。猪场可以根据本场PRV的感染状态,合理运用“清伪灵”免疫,配合合理的生产流程、严格的生物安全等措施来控制伪狂犬病,为清除伪狂犬病打下基础。